Примеры решения задач. Пример 5.1.Промышленная установка, работающая на ванадиевом катализаторе (V2O5), производит в сутки 30 000 кг моногидрата H2SO4
Пример 5.1.Промышленная установка, работающая на ванадиевом катализаторе (V2O5), производит в сутки 30 000 кг моногидрата H2SO4. Объем катализатора в установке 0,7 м3. Рассчитать активность катализатора.
Решение. Мерой активности катализатора является изменение скорости химической реакции в результате введения в систему катализатора. Количественно активность катализатора оценивается производительностью катализатора (Ak). Под производительностью катализатора подразумевают количество вещества, получающееся в единицу времени с единицы площади поверхности (Sk), массы (mk) или объема (Vk) катализатора. Производительность катализатора равна
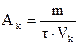 ,
,
где m − масса получаемого вещества; τ − время протекания процесса.
Для определения производительности катализатора выразим время в часах:
Ak = 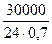 = 1785,7 кг/(м3 ∙ час)
= 1785,7 кг/(м3 ∙ час)
Таким образом, активность ванадиевого катализатора при получении моногидрата H2SO4 равна 1785,7 кг/(м3 ∙ час).
Пример 5.2.Энергия активации некоторой реакции без катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 25 оС?
Решение. Обозначим энергию активации реакции без катализатора через Ea, а с катализатором – через Ea/, соответствующие константы скорости реакции обозначим через k и k/ . Для решения задачи используем преобразованное уравнение Аррениуса lg 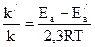 .
.
Подставляя в это уравнение данные задачи, выражая энергию активации в джоулях и учитывая, что Т = 298 К, получим:
lg 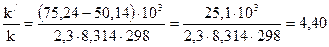
Окончательно находим k//k = 2,5 ∙ 104.
Таким образом, снижение энергии активации на 25,1 кДж привело к увеличению скорости реакции в 25 тысяч раз.
Задачи
№ 5.1. При окислении NH3 на платиновом катализаторе было получено в течение суток 1440 кг HNO3. Для окисления было использовано 0,064 кг катализатора. Рассчитать активность катализатора. (Ответ: 937,5 кг/(м3 ∙ час)).
№ 5.2.Зависит ли значение энергии активации реакции в случае гетерогенного катализа от площади поверхности катализатора и от его структуры?
№ 5.3.Во сколько раз увеличится скорость реакции, протекающей при
298 К, если энергию активации ее уменьшить на 4 кДж/моль?
(Ответ: в 5 раз).
№ 5.4. Чему равна энергия активации реакции, если при повышении температуры от 290 К до 300 К скорость ее увеличится в 2 раза?
(Ответ: 49,9 кДж/моль).
№ 5.5. Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К? (Ответ: 80,3 кДж/моль).
№ 5.6. За 12 ч было синтезировано 45 000 кг NH3. Объем использованного катализатора 1,2 м3. Определить производительность катализатора.
(Ответ: 3125 кг/(м3 ∙ час)).
№ 5.7. Найти объем катализатора для синтеза NH3, если производительность установки 5000 м3 аммиака в час. Производительность используемого катализатора 2000 кг/(м3 ∙ час). (Ответ: 1,9 м3).
№ 5.8. Изменится ли значение константы скорости реакции при замене одного катализатора другим?
№ 5.9.Каков механизм участия в химическом процессе веществ, замедляющих скорость химической реакции и называемых отрицательными катализаторами и ингибиторами?
№ 5.10. Один катализатор снижает энергию активации при 300 К на 20 кДж/моль, а другой на 40 кДж/моль. Какой катализатор эффективнее? Во сколько раз возрастет скорость реакции при использовании того или иного катализатора? (Ответ: второй; 3,1∙103; 9,4∙106).
№ 5.11.Жиры и углеводы окисляются в живых организмах при температуре около 37 оС, а вне живых организмов окисление происходит при 450-500 оС. Объяснить причины этого явления.
№ 5.12.Привести примеры каталитических реакций. Можно ли, с помощью катализаторов, сместить химическое равновесие? Какова роль катализатора в обратимых реакциях?
№ 5.13.Энергия активации некоторой реакции в отсутствие катализатора равна 32,3 кДж/моль, а в присутствии катализатора она равна 20,9 кДж/моль. Во сколько раз возрастет скорость этой реакции в присутствии катализатора при 25 оС? (Ответ: в 100 раз).
№ 5.14. Стенки реакционного сосуда часто оказывают большое влияние на скорость химических процессов, ускоряя или замедляя их. Привести возможные причины этого явления.
№ 5.15. К каким последствиям может привести смещение равновесия под действием катализатора?
№ 5.16. Почему вода в глиняном сосуде не растворяет кремний, а в стеклянном растворяет? Как проверить предложенное объяснение?
№ 5.17.Каково влияние природы растворителя (полярность) на скорость реакции? Можно ли считать, что растворитель в зависимости от природы обладает каталитическим или ингибирующим действием?
№ 5.18. Обычно, чем полярнее растворитель, тем сильнее ослабляются связи в реагирующих молекулах и тем выше становится их реакционная способность. В каком растворителе реакции проходят быстрее? Имеются ли исключения из этого правила?
№ 5.19.Перечислить причины ускорения реакции гетерогенным катализатором.
№ 5.20.Способствует ли повышение температуры первому этапу гетерогенного катализа – адсорбции молекул реагирующих веществ на поверхности твердого катализатора?
Дата добавления: 2015-09-11; просмотров: 7810;
