Теоретическое введение. Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающего в реакцию или образующегося при реакции
Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающего в реакцию или образующегося при реакции, за единицу времени.
Скорость химических реакций зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. В общем случае для реакции
nA + mB = pАВ
зависимость скорости реакции от концентрации выражается уравнением:
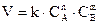 ,
,
где k – константа скорости реакции; CА и CВ – концентрации реагирующих веществ; n и m – коэффициенты перед веществами А и В.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: в гомогенной системе при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза: 
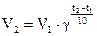 , где V2и V1 – скорость реакции при температурах t2 и t1; γ – температурный коэффициент скорости реакции.
, где V2и V1 – скорость реакции при температурах t2 и t1; γ – температурный коэффициент скорости реакции.
Дата добавления: 2015-09-11; просмотров: 1311;
