Теоретическое введение. Эквивалент(Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях
Эквивалент(Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях. Под реальной частицей понимают реально существующие соединения (NaOH, H2SO4, H2O), под условной – доли этих реальных частиц (½ H2SO4, ½ H2O). Эквивалент – безразмерная величина, состав которой выражают с помощью знаков и формул. Например, Э (NaOH) = NaOH; Э (H2SO4) = ½ H2SO4;
Э (MgCl2) = ½ MgCl2; Э (Са) = ½ Са.
Единицей количества вещества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса одного моля эквивалентов называется молярной массойэквивалентов(Мэк)и выражаетсяв г/моль.
При определении молярной массы эквивалентов необходимо исходить из конкретной реакции, в которой участвует данное вещество.
Молярная масса эквивалентов вещества В, участвующего в окислительно-восстановительной реакции, рассчитывается по формуле
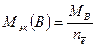 ,
,
где МВ – молярная масса вещества В; 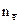 – число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
– число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
Например, в реакции Mg0 + 2H+Cl = Mg+2Cl2 + H20 степень окисления магния изменяется от 0 до +2. Следовательно, магний теряет 2 электрона, т.е. одному электрону эквивалентна условная частица ½ атома Mg.
Э (Mg) = ½ Mg; Мэк (Mg) = 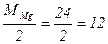 г/моль
г/моль
У водорода степень окисления меняется от +1 до 0, а т.к. молекула водорода состоит из двух атомов, то число принятых электронов будет равно 2. Таким образом, одному электрону эквивалентна условная частица ½ молекулы Н2:
Э (Н2) = ½ Н2; Мэк (Н2) = 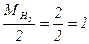 г/моль
г/моль
Закон эквивалентов: массы реагирующих друг с другом веществ пропорциональны их молярным массам эквивалентов:
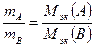
Дата добавления: 2015-09-11; просмотров: 1198;
