Выполнение работы. Определение молярной массы эквивалентов цинка производится в приборе, изображенном на рисунке
Определение молярной массы эквивалентов цинка производится в приборе, изображенном на рисунке. Прибор состоит из трех частей: колбы А, двугорлой склянки Вульфа Б и приемника В. Отверстия двугорлой склянки закрываются резиновыми пробками, через которые проходят стеклянные трубки: короткая, оканчивающаяся сразу под пробкой, и длинная, доходящая почти до дна склянки. Короткая стеклянная трубка соединяется резиновой трубкой с колбой А, а длинная − со стеклянной трубкой Г, опущенной в приемник В.
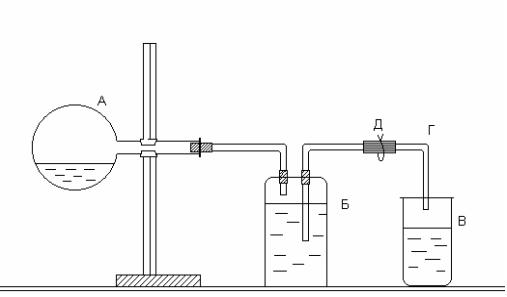
Рис. Прибор для определения молярной массы эквивалентов цинка
Работу следует выполнять в следующем порядке. В колбу налить 10-15 мл соляной кислоты. Закрепить колбу в горизонтальном положении. Получить у преподавателя навеску цинка и поместить ее в сухое горло колбы. Закрыть колбу резиновой пробкой и проверить герметичность прибора. Для этого открыть зажим Д и с помощью резиновой груши вдуть воздух в прибор через стеклянную трубку Г. В приборе создается избыточное давление, вследствие чего вода из трубки Г вытекает. Когда давление внутри прибора станет равным атмосферному, вода из трубки перестанет течь. Закрыть зажим Д. Если вода из трубки Г не уходит, прибор герметичен. Воду из приемника вылить и поставить его под трубку Г.
Наклонить колбу так, чтобы навеска цинка упала в кислоту, и открыть зажим. Водород, выделившийся при взаимодействии металла с кислотой, вытесняет воду из склянки Б в приемник В. Когда весь металл растворится, закрыть зажим, осторожно вынуть из приемника трубку Г (следить, чтобы из нее не вылилась вода) и измерить мерным цилиндром объем воды в приемнике. Этот объем равен объему водорода, выделившегося при взаимодействии цинка с кислотой. Записать показания барометра и термометра.
Требования к результатам работы:
Исходные данные и результаты расчетов занести в табл. 1.
Данные опыта и результаты расчетов Таблица 2.1
| Масса цинка m (Zn), г | Объем выделившегося водорода V , л | Условия опыта | Масса водорода m (H2), г | Молярная масса эквивалентов цинка | |||
| Температура Т, К | Давл. атмосф. Р1, кПа | Давл. водян. пара Р2, кПа | практич. Мэк,пр.(Zn), г/моль | теоретич. Мэк,т. (Zn), г/моль | |||
Вычислить (все вычисления пояснить словами):
1. Массу выделившегося объема водорода, пользуясь уравнением
Менделеева – Клапейрона: 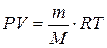 , откуда
, откуда 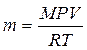
где P – парциальное давление водорода, кПа; V – объем выделившегося водорода, л; m – масса водорода, г; M – молярная масса водорода, г/моль; Т – температура опыта, К; R – универсальная газовая постоянная, равная 8,314 Дж/моль·К.
В нашем опыте водород собирается над водой, содержит водяной пар, поэтому для вычисления парциального давления водорода нужно из величины атмосферного давления вычесть величину давления насыщенного водяного пара при температуре опыта (табл.2). Р = Р1 - Р2.
2. Молярную массу эквивалентов цинка Мэк,пр.(Zn) по закону эквивалентов:
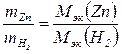
3. Теоретическое значение молярной массы эквивалентов цинка Мэк,т.(Zn):
Мэк,т.(Zn) = 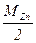
4. Относительную ошибку опыта Е:
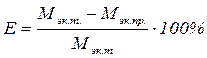
Таблица 2.3
Дата добавления: 2015-09-11; просмотров: 1391;
