Химические свойства. Особенности ароматических соединений
Особенности ароматических соединений. Бензол является первым представителем ароматических углеводородов. Он обладает рядом своеобразных свойств, отличающих его от изученных ранее предельных и непредельных ациклических углеводородов. Ароматический характер бензола определяется его строением и проявляется в химических свойствах.
Состав бензола выражается формулой C6H6. Общая формула гомологов ряда бензола CnH2n-6. Разность между этой формулой и формулой ряда предельных углеводородов CnH2n+2 равна 8Н. Следовательно, по химическому составу бензол и его гомологи являются непредельными соединениями. Их непредельный характер не проявляется в типичных реакциях. Можно было бы ожидать, что бензол будет вести себя подобно этилену, бутадиену и другим типичным непредельным углеводородам. Однако, он не обесцвечивает бромную воду, т. е. в обычных условиях не присоединяет бром. Раствор марганцевокислого калия при взбалтывании с бензолом не обесцвечивается, т. е. бензол устойчив в этих условиях к окислению. Даже при длительном кипячении с раствором КМn04 бензол почти не окисляется. Для него, в основном, характерны реакции замещения:
а) В присутствии катализаторов — кислот Льюиса (FeCl3, АlСl3) хлор и бром замещают атомы водорода в молекуле бензола:

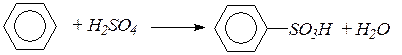
б) Концентрированная серная кислота не вызывает полимеризации бензола, как это происходит в случае алкадиенов, а приводит к получению бензолсульфокислоты:
в) При действии нитрующей смеси (концентрированные НNO3 и H2SO4) происходит нитрование ядра (введение в ядро нитрогруппы -NO2) с образованием нитропроизводных бензола.
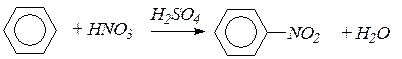
нитробензол
Классификация реакций замещения. При замещении в бензольном кольце возможны три типа реакций в зависимости от природы атакующей частицы.
1. Радикальное замещение. Если атакующий агент R• – радикал, несущий неспаренный электрон, то водород, связанный с атомом углерода ядра, отщепляется с одним из электронов электронной пары 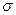 -связи. Такой тип замещения называется радикальным. Реакция радикального замещения редко используется в ароматическом ряду.
-связи. Такой тип замещения называется радикальным. Реакция радикального замещения редко используется в ароматическом ряду.
R• + Н-С6Н5  R-С6Н5 + Н•
R-С6Н5 + Н•
2. Нуклеофильное замещение. При действии несущих отрицательный заряд нуклеофильных частиц на замещенный бензол С6Н5Х (где Х – заместитель), отщепляющаяся группа Х- уходит вместе с парой 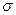 -электронов, ранее осуществлявших ее связь с ядром:
-электронов, ранее осуществлявших ее связь с ядром:
Z- + X: C6H5  Z-C6H5 + X-
Z-C6H5 + X-
Примером может служить реакция взаимодействия натриевой соли бензолсульфокислоты со щелочью. Эта реакция лежит в основе промышленного метода получения фенола:
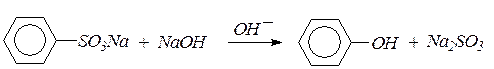
Как правило, для успешного протекания реакций нуклеофильного замещения в ядре должен находиться дополнительно один или лучше два сильных электроноакцепторных заместителя (–NO2, –SO3Н, –СF3).
3. Электрофильное замещение.
Z+ + X:C6H5  Z-C6H5 + X+
Z-C6H5 + X+
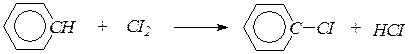
Во всех реакциях этого типа атакующий реагент (Y+) несет на атоме, вступающем в связь с углеродным атомом бензольного ядра, положительный заряд либо имеет ярко выраженный катионоидный характер и образует новую связь за счет пары электронов, ранее осуществлявшей связь С-Н. Замещающийся атом водорода уходит в виде протона (Н+).
Реакции присоединения к бензолу.В отдельных редких случаях бензол способен к реакциям присоединения. Гидрирование, т. е. присоединение водорода, происходит при действии водорода в жестких условиях в присутствии катализаторов (Ni, Pt, Pd). При этом молекула бензола присоединяет три молекулы водорода с образованием циклогексана:
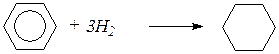
циклогексан
Если раствор хлора или брома в бензоле подвергнуть действию солнечного света или ультрафиолетовых лучей, то происходит радикальное присоединение трех молекул галогена с образованием сложной смеси стереоизомеров гексахлорциклогексана (гексахлорана):
|
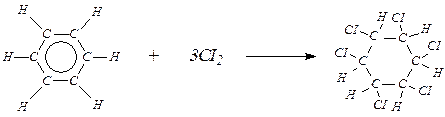
Таким образом, ароматический характер бензола (и других аренов) выражается в том, что это соединение, по составу являясь непредельным, в целом ряде химических реакций проявляет себя как предельное соединение; для него характерны химическая устойчивость, трудность реакций присоединения. Только в особых условиях (катализаторы, облучение) бензол ведет себя как триеновый углеводород.
5.2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Дата добавления: 2015-09-11; просмотров: 3528;
