Химические свойства спиртов
Отличительной особенностью физических свойств спиртов по сравнению с углеводородами с тем же числом атомов углерода являются их более высокие температуры кипения, что связано с высокой полярностью связи О-Н и легкостью образования водородной связи между молекулами спирта:
…О – Н…О – Н…О – Н…
│ │ │
R R R
Низшие спирты хорошо растворимы в воде вследствие образования водородной связи с молекулами воды. Увеличение углеводородного радикала снижает способность к образованию водородных связей и тем самым приводит к снижению растворимости. Закономерности изменения свойств спиртов в гомологическом ряду аналогичны таковым в ряду углеводородов.
Реакционная способность спиртов определяется наличием функциональной группы О-Н, полярность которой обуславливает слабую тенденцию диссоциировать с образованием алкоксид-аниона и протона:
R – OH  R – O - + H+
R – O - + H+
Кислотность атома водорода гидроксильной группы примерно такая же, как у атомов водорода в молекуле воды (КН20 = 1,8*10-16, КСН3ОН » 10-17).Это означает, что по отношению к сильным основаниям, какими являются щелочные металлы, спирты проявляют кислотные свойства, обуславливающие реакции спиртов с разрывом связи RO – H. Кислотные свойства спиртов уменьшаются в ряду: первичные> вторичные >третичные.
Другой тип реакций обусловлен разрывом связи R–OH(основные свойства). Первой стадией таких реакций обычно является протонирование атома кислорода, приводящее к ослаблению связи R–OH. Например, реакция этанола с иодистоводородной кислотой начинается с переноса протона:
С2Н5ОН + НI  C2H5OH2 + I-
C2H5OH2 + I-
Затем алкилоксоний-катион теряет молекулу воды, превращаясь в галогеналкан. Спирты растворяются в сильных кислотах вследствие протонирования атома кислорода и образуют неустойчивые оксониевые соли (аналоги значительно более устойчивых аммониевых солей), которые растворяются в избытке этих кислот:
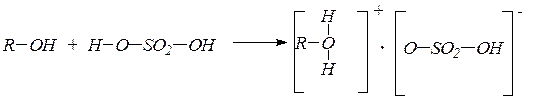
оксониевая соль
Основные свойства наиболее сильны у третичных спиртов и падают в ряду: третичные > вторичные> первичные. Это объясняется +I-эффектом алкильных групп, которые стабилизируют оксоний-катион.
Спирты, таким образом, являются амфотерными соединениями и в этом отношении напоминают воду.
Наиболее характерные химические свойства спиртов.
1. Взаимодействие с щелочными металлами:
2ROH + 2Na = 2RONa + H2
2. Реакция этерификации – образование сложных эфиров карбоновых и минеральных кислот:
ROH + R*COOH  R*COOR + H2O
R*COOR + H2O
ROH + HONO2 ® RONO2 + H2O – алкилнитратов;
ROH + HOSO2OH ® ROSO2OR + 2H2O – диалкилсульфатов;
ROH + (HO)3PO ® (RO)3PO +3 H2O – триалкилфосфатов
ROH + HX ® RX + H2O – алкилгалогенидов
В случае многоосновных кислот могут образовываться кислые эфиры, в которых не все атомы водорода заменены алкильными группами, например, RSO2OH – алкилсерная кислота,ROPO(OH)2 – алкилфосфорная кислота, (RO)2PO(OH) – диалкилфосфорная кислота. Алкилэфиры минеральных кислот, прежде всего диалкилсульфаты и алкилгалогениды, служат важными алкилирующими реагентами, эфиры фосфорной кислоты – важными компонентами ряда метаболических процессов в организме, некоторые из них обладают свойствами пестицидов и вследствие своей токсичности потенциально являются химическими боевыми веществами.
3. Замена гидроксила на галоген легко осуществляется с помощью галогенидов фосфора PCI3, PCI5, PBr3, PI3 или хлористого тионила SOCI2:
ROH + PCI5 ® R – CI + POCI3
ROH + SOCI2 ® R – CI + SO2 + HCI
Действие галогеноводородов на спирты также приводит к образованию галогеналканов. Легче всего реагирует HI, при проведении реакции с HBr требуется нагревание, а при использовании HCI необходимо присутствие катализатора, например,ZnCI2. Алкилгалогениды можно считать эфирами галогеноводородных кислот.
4. Дегидратация спиртовможет протекать по двум направлениям:
а) межмолекулярная в присутствии каталитических количеств серной кислоты и избытке спирта при 140оС с образованием простых эфиров через промежуточное образование алкилгидросульфата
ROH + HOSO2OH ® ROSO2OH + H2O
ROSO2OH + HOR® R–O-R + H2SO4
б) внутримолекулярная при температуре выше 160оС и избытке серной кислоты с образованием алкенов
R-СН2-СН2OH + HOSO2OH® R–СН2-СН2OSO2OH + H2O
R–СН2-СН2OSO2OH ® R–CH=CH2 + H2SO4
5. Окисление и дегидрирование с образованием альдегидов, кетонов и даже карбоновых кислот в зависимости от того, первичный или вторичный спирт участвует в реакции в соответствии со схемой:
RCH2OH ® RCHO ® RCOOH
R2CHOH ® R2CO
В качестве окислителей используют бихромат калия или перманганат калия в кислой среде, кислород в присутствии катализаторов на основе солей органических кислот.
Окисление спиртов можно проводить и с помощью каталитического дегидрирования на Сu, Ag, Ni, Pd, Pt:
RCH2OH ® RCHO + H2
R2CHOH ® R2CO
Третичные спирты окисляются в более жестких условиях (KMnO4 + H2SO4) с разрывом углеродной цепи и образованием кетонов и кислот.
Многоатомные спирты по химическим свойствам сходны с одноатомными, однако, имеют ряд отличий, связанных с наличием нескольких гидроксигрупп, что и позволяет их отличить от одноатомных. Качественной реакцией на многоатомные спирты является реакция образования растворимых комплексных соединений с гидроксидом меди (II).
Дата добавления: 2015-09-11; просмотров: 2214;
