Закономірності укладання білкової глобули
Перше й головне твердження щодо процесу укладання поліпептидного ланцюга в нативну глобулу полягає в тому, що просторова структура нативного білка і шлях її формування повністю визначаються амінокислотною послідовністю, і тільки амінокислотною послідовністю. Процес укладання білка в нативну структуру – це пошук конформації, яка відповідає мінімуму вільної енергії для даної послідовності амінокислот, і, відповідно, є найстабільнішою. Певне уявлення просвоєрідний енергетичний ландшафт, що відповідає загальному набору різноманітних конформацій амінокислотного ланцюга, дає рис. 33 (зрозуміло, що насправді кількість конформаційних координат значно більше двох – конформаційний простір є багатовимірним).
Нативна структура глобулярного білка завжди відокремлена від інших конформацій особливо глибоким мінімумом – знаходиться в енергетичній ямі (рис. 33). Наявність такої ями, яка відповідає стабільному щільно упакованому гідрофобному ядру, забезпечує надійність функціонування білка: теплові флуктуації не здатні вивести структуру з такої ями.
Величезна кількість конформацій, у принципі доступних для поліпептидного ланцюга, поставила проблему, відому як парадокс Левінталя (Cyrus Levinthal). Якщо кожен амінокислотний залишок має ~10 конформацій, ланцюг зі 100 залишків – 10100 конформацій. За найнижчою оцінкою перемикання однієї конформації відбувається за ~10–13 с, тобто, щоб перебрати всі конформації потрібно щонайменше 1080 років, що значно перевищує вік Всесвіту. Аналогія конформаційного простору з ландшафтом (рис. 33) відразу дає рішення цього парадоксу: річка не перебирає увесь ландшафт, вона просто тече одним або кількома альтернативними низькими руслами, впадаючи врешті решт у найнижчу яму. Так само й для поліпептидного ланцюга існують певні виділені”шляхи укладки, які відповідають ієрархії структури білка.
Спочатку за рахунок локальних взаємодій утворюються елементи вторинної структури з гідрофобними поверхнями. Водночас завдяки гідрофобних взаємодій вони злипаються між собою, утворюючи розплавлену глобулу. Цей процес відбувається досить швидко – за кілька мікросекунд. На другому етапі, який потребує значно більшого часу (кілька секунд чи навіть хвилин), реалізується щільна упаковка глобули за рахунок вандерваальсових взаємодій з утворенням твердої нативної молекули, що відповідає глобальному мінімуму вільної енергії.
Конформація ланцюга змінюється, прямуючи через локальні мінімуми енергії, які відокремлені один від одного невисокими бар’єрами. Бар’єри легко долаються за рахунок теплових флуктуацій, і ланцюг нарешті опиняється у глибокому глобальному мінімумі. Але на такому шляху можливі енергетичні пастки (рис. 34) – досить глибокі мінімуми, з яких неможливо вибратися за розумний час, оскільки глибина такої локальної ями перевищує енергію теплових флуктуацій.
Однією з головних причин виникнення енергетичних пасток є агрегація поліпептидних ланцюгів. У стані розплавленої глобули, яка відрізняється від нативної великомасштабними рухами своїх частин, час від часу відбувається вихід на поверхню значної частини гідрофобних залишків. Відповідно, недоструктуровані поліпептидні ланцюги будуть прагнути утворити великі неспецифічні агрегати з метою заекранувати неполярні групи від молекул води. Агрегат і є пасткою – опиняючись у мінімумі вільної енергії, він практично не допускає дисоціації своїх елементів і не дозволяє їм продовжити процес пошуку нативної структури. Зрозуміло, що ефективність агрегації зростає при підвищенні концентрації поліпептидів, а також при зростанні температури (яке підсилює і рухливість глобули, і гідрофобні взаємодії).
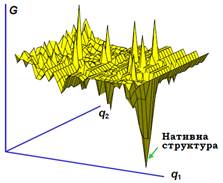
Рис. 33. Схематична тривимірна проекція конформаційного простору поліпептидного ланцюга – залежність вільної енергії (G) від двох параметрів (q1, q2), які характеризують конформацію ланцюга.

Рис. 34. Енергетична пастка на шляху укладання поліпептидного ланцюга вздовж однієї конформаційної координати (див. рис. 33).
Повертаючись до сформульованої вище догми про визначення шляху укладки білка його первинною структурою, слід зауважити, що процес укладки може просто не дійти до свого кінця. Численні експерименти in vitro свідчать про те, що догма повністю підтверджується: практично будь-який білок у денатурованому стані можна без жодних специфічних факторів ренатурувати – відновити його нативну структуру й функцію. Але успішна ренатурація є можливою, якщо штучно створити певні умови та режим її здійснення:
• Перш за все, бажано проводити ренатурацію поступово, повільно повертаючи зовнішні умови до фізіологічних. У результаті на проміжних етапах ренатурації будь-який локальний мінімум енергії не буде надто глибоким і не зможе спрацювати як енергетична пастка: ланцюг зможе швидко перебирати різні недуже стабільні конформації, реалізуючи конформаційну рівновагу, зсунуту до певного найнижчого мінімуму енергії.
• Другою важливою умовою є здійснення ренатурації при низькій концентрації білка – з метою запобігти неспецифічній агрегації. Крім цих загальних правил, у кожному випадку часто доводиться підбирати умови ренатурації окремо: визначати оптимальний режим зміни концентрації солі, температуру, концентрації субодиниць білка з четвертинною структурою тощо.
Зрозуміло, що все це неможливо здійснити in vivo – достатньо сказати, що загальна середня концентрація білків у клітині становить ~100 мг/мл або більше. Тобто клітинні умови є дуже агресивними для поліпептидного ланцюга, що перебуває у процесі пошуку своєї нативної конформації, і без спеціальних механізмів більшість білків просто не встигли б після свого синтезу таку конформацію знайти, швидко опинившись у складі агрегату. Такі механізми – створення рівноважних умов поступового пошуку нативної структури та захист від агрегації – забезпечуються спеціальними білками – шаперонами (від фр.chaperon – капюшон, або особа, що супроводжує незайману дівчину).
Шаперони не визначають ані нативну структуру білка, ані шляхїї укладання – і те, й інше детермінується амінокислотною послідовністю. Головна функція шаперонів – забезпечити умови для швидкого пошуку нативної конформації, створюючи своєрідний інкубатор для неструктурованого поліпептидного ланцюга. Серед досить великої кількості шаперонів є специфічні – зокрема такі, що обслуговують процеси збирання мультибілкових комплексів і субодиничних білків. Більш універсальні шаперони відносять до родини hsp – білків теплового шоку (heat shock proteins). Білки hsp є загальним компонентом клітин для всіх таксономічних груп, у пойкілотермних організмів транскрипція на генах hsp активується у відповідь на зростання температури до 30 – 40 °С при гальмуванні транскрипції більшості інших генів (тепловий шок).
Дата добавления: 2015-09-11; просмотров: 1248;
