Регуляція трансляції
Прокаріотична мРНК має досить невеликий час життя – практично вона існує під час транскрипції та відразу після неї. Регуляція експресії гена у прокаріотів здійснюється переважно на рівні транскрипції (хоча білковий синтез може бути залученим до такої регуляції). Для еукаріотів регуляція трансляції є, навпаки, дуже важливим окремим елементом загальної регуляції експресії.
Регуляція на рівні ініціації трансляції – це один із найважливіших механізмів. Ефективність ініціації трансляції залежить насамперед від:
• Контексту послідовності, в якій знаходиться стартовий кодон – відхилення цього контексту від послідовності Козак (див. вище) утруднює впізнання стартової точки і, відповідно, зумовлює необхідність позитивної регуляції.
• Відстані стартового кодона від 5′-кінця мРНК – довге сканування матриці під час ініціації підвищує ймовірність руйнування преініціаторного комплексу.
• Наявності / відсутності дволанцюгових шпильок у 5′-кінцевій зоні мРНК, що не транслюється, які гальмують процес сканування.
• Присутності / відсутності регуляторних білків, які зв’язуютьсяу 5′-кінцевій зоні. Крім того, у деяких випадках (РНК пікорнавірусів, мРНК факторів росту фібробластів) процес ініціації відбувається за ефективним внутрішнім механізмом незалежно від сканування: завдяки наявності особливих послідовностей (IRES – Internal Ribosome Entry Site), що безпосередньо впізнаються елементами системи ініціації.
Один із прикладів участі білків у негативній регуляції ініціації трансляції наведено на рис. 31. Білок, який утримує залізо в клітині – феритин – має з’являтися негайно після проникнення в цитоплазму цього необхідного, але отруйного у вільному вигляді мікроелемента. Тому мРНК феритину завжди міститься в цитоплазмі, у відсутності заліза – у неактивному стані. Інактивація забезпечується за рахунок зв’язування репресора (який блокує процес сканування) зі шпилькою у 5′-кінцевій зоні.

Рис. 31. Регуляція синтезу феритину.
Як репресор виступає аконітаза (один із ферментів циклу Кребса (Hans Adolf Krebs)). При появі заліза воно зв’язується аконітазою, що викликає звільнення аконітази від мРНК і, як наслідок, активацію трансляції феритину. Синтезований феритин зв’язує залізо, забираючи його в аконітази, яка повертається на мРНК і зупиняє трансляцію.
Мішенню глобальної регуляції на рівні ініціації є також фактори ініціації. Наприклад, фосфорилювання / дефосфорилювання eIF2 приводить, відповідно, до його деактивації / активації. Крім регуляторних білків, до регуляції трансляції залучаються також маленькі РНК. Серед них є такі, що мають стимулюючий вплив на трансляцію: РНК деяких вірусів, РНК продукти транскрипції Alu-повторів гальмують фосфорилювання eIF2, сприяючи активації трансляції. Молекули мікроРНК, навпаки, гальмують трансляцію (частіше на етапі сканування матриці) за рахунок комплементарної взаємодії з мРНК.
Елонгація трансляції також є мішенню регуляторних впливів. Швидкість елонгації варіює в досить широких межах відносно середнього значення, іноді рибосома може зупинятися на певний час. Паузи відбуваються на кодонах, які відповідають мінорним тРНК, зміна концентрації яких є одним зі шляхів регуляції швидкості трансляції. Підвищення загальної швидкості трансляції пов’язане з адаптацією наборів аа-тРНК – узгодженням між частотою найуживаніших кодонів і відповідних ізоакцепторних тРНК. Наявність шпильок усередині кодуючої частини мРНК також гальмує елонгацію, як і репресори, які впізнають елементи послідовності мРНК.
Однією з мішеней регуляції є також фактори елонгації, котрі (як і фактори ініціації) піддаються певним модифікаціям, що зумовлюють активацію / інактивацію факторів. Екстремальний приклад – дифтерійний токсин, який інактивує фактор eEF2 і повністю вимикає білковий синтез. Особливим випадком є включення в кілька важливих білків (присутні в усіх організмів ферменти, що належать до класу оксидоредуктаз) модифікованої амінокислоти селеноцистеїну (яка є елементом активного центру цих ферментів). Селеноцистеїнова тРНК (продукт особливого тРНКгена) здатна впізнавати внутрішній стоп-кодон UGA, фланкований (у напрямку до 3′-кінця) специфічною шпилькою. Ця тРНК спочатку акцептує Ser, який далі перетворюється на селеноцистеїн відповідними ферментами (відбувається заміна ОН-групи на групуSeH).
Селеноцистеїн-тРНК зв’язується зі специфічним аналогом елонгаційного фактора EF1 (позначається як SelB у прокаріотів і як SECIS в еукаріотів). Шпилька в мРНК упізнається або самим цим специфічним фактором елонгації (прокаріоти), або ще одним білком, з яким цей фактор елонгації взаємодіє (еукаріоти), що й забезпечує зв’язування селеноцистеїн-тРНК з А-сайтом рибосоми.
Зміна часу життя мРНК – ще один шлях регуляції трансляції. Час життя мРНК у цитоплазмі залежить головним чином від ступеня захищеності 3′-кінця від екзонуклеаз (оскільки кеп є нечутливим до нуклеаз). Досить типову ситуацію ілюструє приклад регуляції трансляції іншого білка, який має відношення до обміну заліза, – рецептора трансферину (рис. 32).
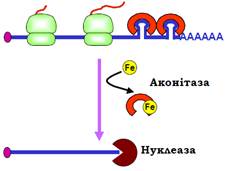
Рис. 32. Регуляція синтезу рецептора трансферину.
Трансферин є позаклітинним переносником заліза, транспорт заліза в цитоплазму залежить від кількості рецепторів трансферину в мембрані. У відсутності заліза всередині клітини на мРНК рецептора здійснюється синтез білка, мРНК при цьому стабілізована: аконітаза зв’язана зі шпильками в 3′-кінцевій зоні, що блокує нуклеазну деградацію. Зростання концентрації заліза викликає дисоціацію аконітази, і починається швидка деградація мРНК.
Дата добавления: 2015-09-11; просмотров: 2099;
