Шапероніни
Особливий клас шаперонів, побудованих із білків hsp60, об’єднують у групу шаперонінів. Бактеріальний шаперонін (шаперонін І) містить два комплекси, кожен з яких сформований сімома молекулами hsp60 (інша назва GroEL). Комплекс має форму кільця з каналом ~45 Å у діаметрі, утворюючи своєрідну мікропробірку (рис. 37), яка може закриватися кришечкою, утвореною із 7 молекул hsp10 (інша назва GroES).
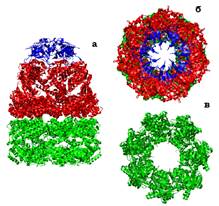
Рис. 37. Структура шапероніну GroEL (1WE3) у різних проекціях. Два семичленних кільця hsp60 зафарбовані зеленим і червоним,7 субодиниць hsp10 – синім.
Еукаріотичні аналоги (шапероніни ІІ) мають подібну будову, але кожне кільце формується з восьми або дев’яти субодиниць, додаткові структурні домени яких утворюють кришечку, що закривається / відкривається в результаті структурних перебудов.
Кожна субодиниця кільця, і на цьому базується принцип роботи шапероніну, існує принаймні у двох структурних формах (рис. 38). Перша (у двох варіантах, що трохи розрізняються) реалізується в комплексі з АТР або ADP і характеризується: 1) високою спорідненістю до hsp10 (що сприяє утворенню кришечки); 2) низькою гідрофобністю своєї поверхні. Дисоціація ліганду (ADP після гідролізу АТР) індукує структурну перебудову зі взаємним переміщенням трьох структурних доменів. При цьому втрачається спорідненість до hsp10 (відкриття кришечки) і на внутрішню поверхню білка (усередині каналу мікробірки) експонуються гідрофобні групи.

Рис. 38. Два структурні стани hsp60 (1WE3): зв’язаний з ADP у комплексі з молекулою hsp10 (червоний) і вільний від ліганду (зелений).
Зв’язування та гідроліз АТР, дисоціація ADP і відповідні перебудови відбуваються синхронно для семи субодиниць одного кільця (позитивна кооперативність у межах кільця), але два кільця працюють за принципом негативної кооперативності: перший стан одного кільця сприяє реалізації другого стану в іншому кільці (як на рис. 37).
Робочий цикл шапероніну показано на рис. 39. Через відкритий отвір мікропробірки всередину потрапляє поліпептидний ланцюг. Кільце hsp60 (верхнє на рис. 39, розглянемо саме його) перебуває при цьому в стані, що не зв’язує жодного ліганду: кришечка відкрита, поліпептид фіксується всередині каналу в розгорнутому вигляді за рахунок гідрофобних взаємодій. Зв’язування семи молекул АТР викликає структурну перебудову: кришечка закривається, гідрофобність внутрішньої поверхні каналу зникає – поліпептид (повністю захищений від зовнішнього середовища) має змогу здійснювати власну укладку. На це він має ~20 с – час, поки існує зв’язаний АТР, після чого відбувається його гідроліз (за рахунок активності hsp60) і потім залишається зв’язаний ADP. Зв’язування АТР з нижнім кільцем індукує дисоціацію ADP від субодиниць верхнього: кришечка відкривається, і білок зі сформованою нативною структурою – гідрофобних груп практично немає на його поверхні й він не прилипає до стінок каналу – виходить через отвір мікробірки. Для більшості білків проміжок у 20 с є цілком достатнім, щоб знайти нативну конформацію. Якщо цього не відбулося, процес може повторитися.
Рис. 39. Робочий цикл шапероніну. Структуру схематично зображено в розрізі: для кожного кільця показано по дві субодиниці, кожна складається з трьох доменів. Червоний і зелений колір відповідають різним структурним станам кільця (як на рис. 37, 38), синій – hsp10.
Дата добавления: 2015-09-11; просмотров: 1185;
