Базальні фактори транскрипції
Послідовність збирання преініціаторного комплексу може бути різною, але всі базальні фактори мають бути присутніми у складі РІС для подальшого запуску транскрипції.
TFIID – один із найважливіших базальних факторів, який визначає впізнання стандартних елементів базального промотора (якщо вони присутні). Основою структури TFIID є ТВР (TATA-box Binding Protein) – білок зі специфічною спорідненістю до ТАТА-боксу. Досить широкий β-шар у складі ТВР взаємодіє з маленьким жолобком ДНК, наслідком чого є суттєва деформація подвійної спіралі з її розкручуванням та значним вигином у протилежний від білка бік. Саме з цього протилежного боку (усередині вигину) розташовуються інші білкові компоненти преініціаторного комплексу, які обгортаються промотором (див. нижче). Отже, вигин ДНК, який індукується ТВР, організує промотор і зв’язані з ним елементи в єдиний компактний комплекс і підтримує його стабільність. Досить часто (але не обов’язково) зв’язування TFIID ініціює збирання РІС. Із ТВР у складі TFIID зв’язані так звані ТВР-асоційовані фактори (TAFs – TBP Associated Factors) – вісім або більше білків (конкретний склад факторів варіює для різних промоторів). TAFs взаємодіють з ТВР і між собою, деякі з них здатні також взаємодіяти з ДНК. Зокрема, TAFІІ150 (або його аналог, 150 – молекулярна вага в кілодальтонах) упізнає DPE (рис. 4), тобто забезпечує зв’язування TFIID із базальним промотором, у складі якого відсутній ТАТА-бокс. Якщо у промоторі немає також і DPE, інші TAFs здійснюють білок-білкові взаємодії з факторами транскрипції, що зв’язані з іншими елементами послідовності.
Наприклад, GC-бокс упізнається транскрипційним фактором Sp1(Specificity protein 1), який, у свою чергу, рекрутує TAFІІ110, що стає компонентом TFIID через взаємодію з TAFІІ250 (рис. 4).
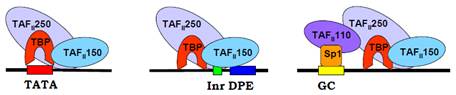
Рис. 4. Взаємодія TFIID з базальним промотором через ТВР (якщо присутній ТАТА-бокс), через один з TAFs (якщо присутній DPE), через інший TAF, що взаємодіє з транскрипційним фактором, зв’язаним із GC-боксом.
Білок TAFІІ250 є практично обов’язковим компонентом TFIID (як і ТВР), виконуючи роль основного фактора збирання, з яким взаємодіють інші TAFs. Крім того, TAFІІ250 містить у своєму складі бромодомен і гістонацетилтрансферазну активність: відповідно, здатен як впізнавати ацетильовані гістони в зоні промоторів, такі здійснювати таке ацетилювання.
TFIIA – гетеродимерний білок, кофактор, що стабілізує комплекс ТВР з ДНК. Відповідно, цей фактор можна було б вважати ще одним TAF. У системах in vitro TFIIA не є необхідним для ініціації транскрипції, проте його відсутність у клітинах дріжджів є летальною. TFIIB – мономерний білок із мультидоменною структурою. Два С-кінцеві домени взаємодіють із ДНК по обидва боки від сайта зв’язування ТВР, із внутрішнього боку вигину, який індукується цим білком (рис. 5). Таким чином, два білки, які взаємодіють також між собою, зв’язуються з ДНК кооперативно, взаємно підсилюючи спорідненість до неї. Два С-кінцеві домени TFIIB мають різну структуру і взаємодіють з різними елементами ДНК (маленьким та великим жолобками). Така асиметрія (існування двох альтернативних варіантів зв’язування з ДНК) відіграє роль у визначенні напрямку транскрипції. Це пов’язано з тим, що N-кінцева частина TFIIB (практично не має регулярної вторинної структури) взаємодіє з РНК-полімеразою ІІ. Таким чином, саме TFIIB визначає положення полімерази на ДНК відносно стартової точки в одній із двох можливих орієнтацій ферменту.
Витягнута N-кінцева частина TFIIB взаємодіє з РНК-полімеразою в зоні активного центру, після початку транскрипції здійснює взаємодії з РНК-ДНК гібридом, а також блокує канал виходу РНК. Тобто TFIIB певною мірою виконує функції, аналогічні до функцій бактеріального σ-фактора. Відповідно, TFIIB має бути звільненим при переході від ініціації до елонгації транскрипції (див. нижче).
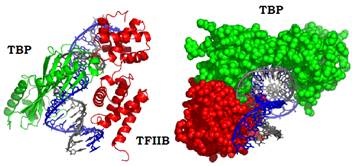
Рис. 5. Комплекс із ДНК ДНК-зв’язувального домену ТВР і С-кінцевої частини TFIIB
у двох проекціях (1D3U).
TFIIF – гетеродимер, взаємодіє з РНК-полімеразою ІІ (у зоні активного центру), з ДНК, з базальними факторами TFIIЕ та TFIIН. Після первинного плавлення ДНК при ініціації транскрипції TFIIF здійснює взаємодії з нематричним ланцюгом, стимулює роботу TFIIН (див. нижче), запобігає абортивній ініціації. Після завершення ініціації TFIIF разом з іншими базальними факторами дисоціює від РНК-полімерази, але може реасоціювати з нею під час елонгації – у випадку зупинки ферменту. Його роль як фактора елонгації транскрипції полягає у стимуляції продовження руху полімерази. TFIIЕ – гетеродимер, стимулює роботу TFIIН, взаємодіє з транскрипційним міхуром при ініціації транскрипції.
TFIIН – найбільший із базальних факторів, складається з 10 субодиниць, має молекулярну вагу, порівняну з такою РНК-полімерази. TFIIН – єдиний базальний фактор, що має ферментативні активності.
Перша з них – АТР-залежна-ДНК-геліказна (гелікази – helicases ферменти, що розкручують подвійну спіраль). Частина TFIIН взаємодіє з ДНК нижче від активного центру полімерази (по ходу транскрипції). Імовірно, конформаційні зміни білка, зумовлені гідролізом АТР, викликають обертання подвійної спіралі навкруг своєї осі, а оскільки вище від активного центру ДНК є жорстко зафіксованою, таке обертання призводить до локального плавлення дуплекса в зоні стартової точки. РНК-полімераза ІІ є єдиною з полімераз, яка потребує такої геліказної активності при ініціації транскрипції, – інші РНК-полімерази, еукаріотичні та бактеріальні, утворюють транскрипційний міхур завдяки певним ДНК-білковим взаємодіям, яким сприяє негативна надспіралізація.
Друга ферментативна активність TFIIН – кіназна, за рахунок якої здійснюється фосфорилювання С-кінцевого домену РНК-полімерази при переході від ініціації до елонгації транскрипції. У дефосфорильованій формі (форма А РНК-полімерази), на стадії збирання преініціаторного комплексу, CTD взаємодіє з базальними факторами транскрипції; після фосфорилювання певних залишків Ser (форма О РНК-полімерази) ця взаємодія порушується.
Медіатор. Ефективне збирання преініціаторного комплексу є можливим лише за участі ще одного структурного модуля – медіатору (mediator), який містить понад 20 субодиниць (склад варіює для різних промоторів – певний мінімальний набір субодиниць доповнюється більш специфічними за рахунок взаємодії з транскрипційними факторами). Цей мультибілковий комплекс має витягнуту структуру, яку можна розділити на три частини: голова (h, head), середня частина (m, middle) і хвіст (t, tail). Медіатор здійснює лише білок-білкові взаємодії: голова й середня частина взаємодіють з РНК-полімеразою, середня частина та хвіст – зі специфічними факторами транскрипції, що зв’язані на проксимальних і дистальних елементах промотора (рис. 6).
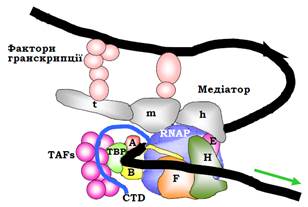
Рис. 6. Схема взаємного розташування елементів у складі преініціаторного комплексу РНК-полімерази ІІ. Стрілкою позначено напрямок транскрипції.
Таким чином, медіатор є засобом передачі активаційних сигналів з регуляторних елементів послідовності на РНК-полімеразу: збільшення кількості взаємодій підсилює ефективність збирання РІС.
Дата добавления: 2015-09-11; просмотров: 1591;
