Принципи білково-нуклеїнового впізнання
Усі випадки взаємодії численних білків із ДНК можна поділити на дві категорії: неспецифічне зв'язування білка з ДНК будь-якої послідовності (характерна константа зв’язування K ~ 105 − 106 л/моль) і специфічне впізнання білком певної послідовності пар основ (із константою ~109 − 1010 л/моль). Білки, що здійснюють таке впізнання, як правило, взаємодіють і з будь-якою іншою ДНК неспецифічно. Розглянемо на простому прикладі, що практично означають наведені цифри.
Нехай у бактеріальній клітині радіусом 1 мкм міститься 10 молекул певного білка та 4 млн 600 тис. пар основ ДНК, де присутня одна специфічна ділянка (оператор). Виходячи з об’єму клітини, можна легко розрахувати загальні молярні концентрації білка та оператора (скориставшись числом Авогадро). Концентрація комплексу з оператором визначається рівнянням (1.6), де вільні концентрації білка та оператора дорівнюють їхнім загальним концентраціям мінус концентрація комплексу. Звідки, якщо відома K, можна розрахувати концентрацію комплексу.
Якщо білок зв’язується неспецифічно (K = 105 л/моль), відношення концентрації комплексу до загальної концентрації оператора дорівнює 4×10-4 − оператор практично є вільним від білка. Та якщо замість концентрації оператора використати загальну концентрацію потенційних сайтів зв’язування на ДНК (білок зв’язується будь де), яка є в 4 млн 600 тис. разів вищою (кожна пара основ потенційно може бути початком сайта зв’язування), то відношення концентрації комплексу до загальної концентрації білка дорівнюватиме 0,995 − практично білок увесь час зв’язаний із ДНК.
При специфічному зв’язуванні (K = 1010 л/моль), відношення концентрації комплексу до загальної концентрації оператора дорівнює 0,97 − десяти молекул білка виявляється достатнім, щоб більшу частину часу оператор був зв’язаним. При цьому з оператором у нашому прикладі в даний момент часу може бути зв’язана лише одна молекула білка, решта перебуває не у вільному стані, а на ДНК, взаємодіючи з нею неспецифічно.
Чим визначається висока специфічність зв’язування? Головне правило білково-нуклеїнового впізнання − відсутність жорстких правил.
Розглянуті різні структурні мотиви білків є різними еволюційними рішеннями для специфічної взаємодії з тією чи іншою послідовністю: існує багато шляхів для того, щоб сформувати білкову поверхню для впізнання послідовності пар основ. Не існує і будь-якого коду впізнання − чіткої відповідності між амінокислотними залишками та парами основ. Але є певні загальні закономірності, частина яких уже має бути зрозумілою з розгляду ДНК-зв’язувальних структурних мотивів. Зокрема, білково-нуклеїновий інтерфейс частіше представлений парою α-спіраль − великий жолобок завдяки хорошій просторовій відповідності між цими двома елементами. Проте використовуються також і β-структура, і перемички між елементами вторинної структури для впізнання пар основ у великому жолобку. Маленький жолобок також використовується для впізнання послідовностей пар основ, причому у випадку взаємодії елементів вторинної структури білка (α-спіраль чи β-структура) із маленьким жолобком така взаємодія супроводжується розкриттям маленького жолобка. Таке розкриття стає можливим унаслідок значної деформації подвійної спіралі (розкручування, вигин, кінк у результаті порушення стекінг-взаємодій).
На поверхні ДНК розташовані фосфатні залишки та донорні / акцепторні групи азотистих основ у жолобках. Саме ці групи й залучаються до контактів з амінокислотними боковими залишками та пептидними групами на поверхні білка. Існує декілька типів контактів (взаємодій) між ДНК і білками: електростатичні взаємодії між позитивно зарядженими амінокислотними залишками та негативно зарядженими фосфатами присутні майже завжди в білково-нуклеїнових комплексах. Зрозуміло, що електростатичні взаємодії відповідають за неспецифічне зв’язування. Як правило, вони додатково стабілізують також і специфічні комплекси. Електростатичне зв’язування білка з нуклеїновою кислотою має цілком ентропійну природу. Висока концентрація негативних зарядів (фосфатів) на поверхні ДНК зумовлює формування навкруг ДНК іонної атмосфери з досить високою локальною щільністю катіонів (рис. 21). Зв’язування позитивно зарядженого білка призводить до визволення частки катіонів у зовнішній розчин, тобто до зростання невпорядкованості (ентропії) у системі. Енергетичний виграш від зв’язування білка (його спорідненість до ДНК) є тим більшим, чим меншою є концентрація солі в розчині, тобто різниця між концентрацією катіонів поблизу від ДНК і на віддаленні від неї.
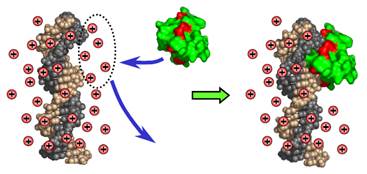
Рис. 21. Електростатичне зв’язування білка (червоним позначені позитивно заряджені амінокислотні залишки) з ДНК за рахунок визволення неорганічних катіонів.
Водневі зв’язки між донорно-акцепторними групами білка та фосфатами й екзоциклічними групами азотистих основ. Водневі зв’язки,оскільки вони потребують чіткої взаємної орієнтації донора й акцептора, відіграють роль головного фактора специфічного впізнання. Кожна послідовність пар основ утворює в жолобках подвійної спіралі власний патерн донорних і акцепторних груп (рис. 22, див. також рис. 7), який і може впізнаватися поверхнею білка. Слід зазначити,що цей патерн більш варіабельний у великому жолобку, де легше розрізнити пари основ і динуклеотидні контакти − це ще одна причина, чому саме великий жолобок частіше використовується для впізнання.
Деякі амінокислотні залишки здатні утворювати два водневі зв’язки з азотистою основою, наприклад, Arg із гуаніном. Проте Arg контактує й з усіма іншими основами. Чи буде певний залишок залученим до утворення водневого зв’язку, і якого саме, залежить від його орієнтаціїна поверхні. Певні закономірності (своєрідний код, коли залишок певного типу в певному місці утворює зв’язок із певною основою) спостерігаються іноді тільки в межах однієї родини структурних мотивів, алей тоді такі закономірності не мають абсолютного характеру.
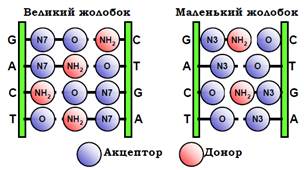
Рис. 22. Патерни донорів і акцепторів водневого зв’язку в жолобках подвійної спіралі для зазначеної послідовності чотирьох пар основ.
Водневі зв'язки, опосередковані молекулами води. Вода взаємодіє з поверхнями як білків, так і ДНК. Визволення води з білково-нуклеїнового інтерфейсу вносить додаткову ентропійну складову у стабілізацію комплексу. Але досить часто окремі молекули води можуть залишатися в інтерфейсі, виконуючи роль біфункціональної зшивки − утворюючи водневі зв’язки з білковими групами та фосфатами або групами азотистих основ.
Гідрофобні контакти можуть здійснюватись за участю метальної групи тиміну у великому жолобку (рис. 7), але суттєвішими є гідрофобні взаємодії при інтеркаляції неполярних амінокислотних залишків між парами основ при деформації подвійної спіралі внаслідок занурення елементів вторинної структури білка в маленький жолобок (рис. 18, 19).
Головною умовою реалізації названих контактів між ДНК і білком є заємна підгонка структури взаємодіючих елементів унаслідок відповідних конформаційних перетворень. Так, шляхом певних конформаційних змін подвійної спіралі (вигини спіралі, зміни твіста тощо) змінюється розмір жолобків, хімічні групи підводяться під водневі зв’язки та міцні електростатичні контакти, збільшується загальна поверхня, що може взаємодіяти з білком. Це означає, що для ефективного впізнання необхідна певна конформація подвійної спіралі та / або певні зміни цієї конформації. І те, й інше визначається послідовністю пар основ. Отже, основою для білково-нуклеїнового впізнання є структурно-динамічний поліморфізм нуклеотидних послідовностей − залежні від послідовності структурні особливості та конформаційна рухливість подвійної спіралі.
При цьому білок також часто потребує певної конформаційної підгонки під подвійну спіраль. Один із прикладів такої, досить значної, конформаційної зміни як у молекулі білка (формування додаткових α-спіралей), так і у молекулі ДНК (вигин подвійної спіралі) при утворенні специфічного комплексу показано на рис. 23. Саме в процесі взаємної конформаційної підгонки білка та ДНК і реалізується специфічний патерн контактів у інтерфейсі між двома молекулами.
Від того, наскільки легко потрібні конформаційні зміни відбуваються при зустрічі конкретного білка з конкретною послідовністю пар основ, залежить ефективність упізнання. Таким чином, головним механізмом упізнання послідовності ДНК білком є структурно-динамічна комплементарність двох молекул.
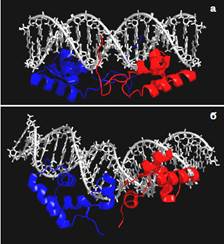
Рис. 23. Структура ДНК-зв’язувальних доменів димеру репресора лактозного оперона E. Coli у комплексі з неспецифічною ДНК (а, 1OSL) та зі своїм специфічним оператором (б, 1L1M).
Дата добавления: 2015-09-11; просмотров: 1414;
