Циркулярна ДНК
ДНК майже завжди існує іn vivo у вигляді циркулярної ковалентно-замкненої молекули (прокаріоти) або у формі, що є еквівалентною циркулярній − у вигляді петель, закріплених своїми кінцями на скелетних структурах клітинного ядра (еукаріоти). У молекулі, два кінці якої жорстко зафіксовані або з’єднані один з одним, виникають топологічні обмеження, і це має важливі біологічні наслідки.
Топологія − це розділ математики, присвячений вивченню таких властивостей просторових об’єктів, які не залежать від деформаційцих об’єктів. Центральним поняттям топології циркулярної ДНК є так зване число зчеплень Lk (linking number) двох полінуклеотидних ланцюгів − двох кілець, закручених одне навкруг одного в подвійну спіраль. Число зчеплень визначається як кількість перетинів одним циркулярним контуром поверхні, що натягнута на другий контур. У найпростішому випадку два кільця можна зчепити одне з одним один раз (Lk = 1, рис. 24), і будь-які деформації кілець (за умови збереження цілісності кожного кільця) не змінять цієї величини: кільця не можна ні розвести, ні збільшити ступінь зчеплень. Отже, і це одна з двох важливих властивостей числа зчеплень, Lk системи двох кілець є постійною величиною – топологічним інваріантом, − поки обидва кільця є інтактними (не містять розривів). Легко уявити два кільця, зчеплені одне з одним два (рис. 24) або сто разів, але не може бути двох з половиною зчеплень, тобто Lk є цілим числом. Саме ці дві властивості числа зчеплень і накладають топологічні обмеження на молекулу циркулярної ДНК.
На рис. 24 показано планарну (вісь подвійної спіралі лежить в одній площині) циркулярну молекулу ДНК з Lk = 20. Зрозуміло, що для такої системи Lk дорівнює кількості витків подвійної спіралі. Кількість витків подвійної спіралі позначається як твіст Tw (twist, дорівнює сумі кутів твіста для всіх пар основ, поділеній на 360°, з позначкою «+»” для правої спіралі та «−» − для лівої), тобто для планарної циркулярної ДНК Lk = Tw. Найвигідніший твіст ДНК Tw0 (часто записується також як Lk0) визначається зовнішніми умовами та послідовністю пар основ (типове середнє значення за фізіологічних умов відповідає приблизно 10,5 парам основ на виток подвійної спіралі), тобто зовсім не повинен бути цілим числом. Лише тоді, коли Tw = Tw0 (припустимо, що ця умова реалізується для прикладу на рис. 23, і Tw0 = 20), при замиканні в кільце ДНК набуде найбільш енергетично вигідної планарної форми, у складі якої реалізується мінімальний вигин молекули.
Якщо ж (як це частіше буває) Tw0 не є цілим числом, замикання в кільце (точне зведення кінців обох ланцюгів) є можливим або за рахунок зміни твіста до цілого значення (треба підкрутити подвійну спіраль, щоб виставити один кінець точно напроти одного), або шляхом додаткових вигинів молекули з відхиленням від планарної форми. У будь-якому разі замикання в кільце буде можливим лише за умови деформацій молекули ДНК.
Отже, у загальному випадку, коли Lk (яке має бути цілим числом) не збігається з Tw0, число зчеплень має дві складові згідно з рівнянням Уайта − Фуллера (James H. White, F. Brock Fuller):
Lk = Tw + Wr,
де райзинг Wr (writhing) − параметр, який є мірою відхилення осі подвійної спіралі від планарної конфігурації (для планарного кільцяWr = 0).
Розподіл величини Lk по двох складових залежить від механічних властивостей молекули ДНК: той факт, що Lk ≠ Tw0, означає наявність деформації (відхилення конформації від найвигіднішої) і ця деформація мінімізується, розподіляючись певним чином між зміною твіста
ΔTw = Tw − Tw0
і ненульовим райзингом унаслідок зростання вигину молекули. Отже, загальною мірою деформації є величина
ΔLk = Lk − Tw0 = ΔTw + Wr.
Оскільки зростання райзингу (при зростанні загальні деформації) пов’язане зі спіралізацією осі подвійної спіралі – надспіралізацією (supercoiling), величина ΔLk використовується як міра надспіралізації в циркулярній ДНК. Таким чином, надспіралізація є тим більшою,чим більше Lk відрізняється від Tw0, і чим більша напруга, пов’язана з деформацією, накопичується в ДНК.
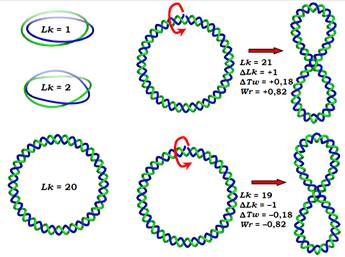
Рис. 24. Ліворуч: два кільця з різним числом зчеплень Lk, у тому числі планарна форма циркулярної ДНК з Lk = 20. Праворуч: збільшення чи зменшення ступеня закрутки подвійної спіралі на один оберт призводить відповідно до позитивної чи негативної надспіралізації.
Описане ілюструє рис. 24 на прикладі ДНК із Tw0 = 20. Якщо зробити одноланцюговий розрив, збільшити кількість витків подвійної спіралі на 1 (закрутити подвійну спіраль торсійно) і зашити розрив, відновивши ковалентний зв’язок, то тим самим кількість зчеплень зросте на 1: ΔLk набуде значення +1, яке розподілиться між зміною твіста та райзингом. У цьому випадку кажуть про позитивну надспіралізацію, яка є топологічно еквівалентною зростанню закрутки подвійної спіралі. Відповідно, розкручення подвійної спіралі після розриву та наступне відновлення цілісності ланцюга призведе до негативної надспіралізації з ΔLk = –1.
Однакові циркулярні молекули ДНК, які різняться лише кількістю зчеплень (як три молекули з Lk = 19, 20 та 21 на рис. 24), називаються топоізомерами. Зрозуміло, що практично застосувати описану процедуру для отримання різних топоізомерів досить важко.
Але це можна зробити, здійснивши ензиматичне зшивання ДНК у кільце в різних умовах, що відповідають різним значенням Tw0. Отримані топоізомери будуть відповідати найменш енергетичним формам − таким, для яких значення Lk є максимально наближеними до значень найвигіднішого твіста. Щойно зациклення відбулося, значення Lk залишається незмінним. А зміна умов і нове значення Tw0 приведе до зростання величини ΔLk у негативний чи позитивний бік і, відповідно, надспіралізації.
З іншого боку, значення Lk залишається незмінним лише за умови цілісності обох полінуклеотидних ланцюгів. Якщо внести хоча б один розрив у хоча б один із ланцюгів, два кінці ланцюга в місці розриву отримають свободу обертатися навкруг інтактного ланцюга. У результаті будь-яка надспіралізація і пов’язана з нею еластична напруга зникнуть − відбудеться релаксація циркулярної ДНК. Для негативно надспіралізованої ДНК існує ще один шлях релаксації (принаймні часткової) без розривів − локальне розкручування подвійної спіралі. Припустимо, що лінійна молекула ДНК із Tw0 = 20 (як на рис. 24) може існувати також у формі зі зруйнованим (розплавленим) одним витком подвійної спіралі, тобто з величиною Tw0 = 19. За фізіологічних умов розведення ланцюгів потребує зростання вільної енергії, тобто така форма є неможливою. Але локальне плавлення подвійної спіралі у складі негативного топоізомеру буде супроводжуватись також зниженням вільної енергії за рахунок релаксації, оскільки ΔLk = 19 − 20 = −1 зміниться на ΔLk = 19 − 19 = 0. У результаті, якщо загальна вільна енергія знизиться, локальна дестабілізація подвійної спіралі стане імовірнішою. За таким самим механізмом − енергетично невигідне конформаційне перетворення стає вигідним за рахунок того, що знімає негативну надспіралізацію в кільці − у негативно надспіралізованій ДНК (за фізіологічних умов!) відбуваються й інші конформаційні перетворення (наприклад, перехід в Z-форму, яка характеризуються розкрученням подвійної спіралі порівняно з В-ДНК). Оскільки більшість функціональних процесів, що відбуваються на ДНК, потребують локального руйнування подвійної спіралі, зрозуміло, що негативна надспіралізація активує ці процеси, полегшуючи таке руйнування на певних найменш стабільних ділянках.
З іншого боку, функціональні процеси (у першу чергу, транскрипція і реплікація) самі призводять до виникнення надспіралізації. Проходження такого процесу пов’язане з пересуванням (транслокацією) уздовж ДНК того чи іншого ферменту (транслокази), який локально руйнує подвійну спіраль. Такими транслоказами є РНК і ДНК-полімерази, які розглядатимуться далі, а також інші ферменти. Оскільки молекула ДНК − спіраль, пересування транслокази має супроводжуватись або її обертанням навкруг осі подвійної спіралі (на кшталт обертання гайки навкруг гвинта), або прокручуванням самої подвійної спіралі (обертанням гвинта в гайці). Саме друга можливість і реалізується, оскільки транслоказа працює завжди у складі величезного мультибілкового комплексу − “гайка” є надто масивною. Крім того, транслоказа може бути заякореною на скелетних структурах, що робить її обертання взагалі неможливим. Якщо (як це має місце у клітині) кінці ДНК жорстко зафіксовані на тих самих скелетних структурах і не можуть обертатися, транслокація буде створювати топологічні проблеми (рис. 25). У процесі пересування вздовж ДНК транслоказа руйнує подвійну спіраль попереду від себей відновлює її позаду. Локальне розкручування подвійної спіралі попереду транслокази має бути компенсованим позитивною надспіралізацією, відновлення спіралі (закручування) − надспіралізацією негативною. У результаті попереду й позаду від транслокази виникають дві “хвилі” надспіралізації протилежного знаку (рис. 25).

Рис. 25. Дві хвилі надспіралізації у процесі роботи транслокази.
Зрозуміло, що накопичення такої надспіралізації (еластичної напруги) не може продовжуватись нескінченно: врешті решт напруга буде блокувати процес транслокації. Отже, має бути спосіб розв’язувати цю проблему − знімати надспіралізацію, релаксуючи ДНК.
Інструментом, який використовується для цього, є спеціальні ферменти − ДНК-топоізомерази (topoisomerases). Оскільки зміна кількості зчеплень є можливою лише за умови порушення цілісності полінуклеотидних ланцюгів, загальний механізм роботи топоізомераз полягає у внесенні розриву (при цьому один кінець ланцюга тимчасово ковалентно пришивається до залишку Tyr у активному центрі ферменту, а інший залишається вільним) і зворотному зшиванні цього розриву; зміна Lk відбувається у проміжку між цими двома подіями. Топоізомерази поділяються на два класи. Топоізомерази І (мономерні білки), які поділяються на два підкласи Іa і Іb, здійснюють одноланцюговий розріз ДНК. Топоізомерази Іа (присутні як у про- так і в еукаріотів) здатні релаксувати тільки негативно надспіралізовану ДНК. Фермент упізнає дестабілізовану ділянку подвійної спіралі (яка має бути присутньою в негативно надспіралізованій молекулі, див. вище), робить одноланцюговий розрив і протягує крізь нього інтактний ланцюг (рис. 26). У результаті число зчеплень змінюється на одиницю в напрямку зниження рівня негативної надспіралізації.
Оскільки впізнається дестабілізована ділянка, топоізомераза Іa спрацьовує тільки за наявності досить високої негативної надспіралізаціїі не здатна релаксувати ДНК повністю − знизити ΔLk до 0. Основна роль топоізомераз цього типу − підтримувати певний оптимальний рівень надспіралізації в ДНК бактеріальної клітини.
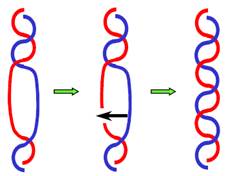
Рис. 26. Схема дії топоізомераз Іa.
Топоізомерази Іb (тільки еукаріотичні) переводять будь-яку ДНК у максимально релаксований стан. Механізм їхньої дії є дуже простим: мультидоменний мономерний білок зв’язується з ДНК, оточуючи подвійну спіраль з усіх боків (рис. 27); здійснюється одноланцюговий розрив (див. рис. 27, а); один із кінців, які утворилися, отримує змогу вільно обертатися навколо інтактного ланцюга; після трьох-чотирьох випадкових обертів розрив зшивається, і фермент дисоціює. Оскільки оберти є вільними, вони здійснюються в напрямку зниження напруги − максимальної релаксації. Зрозуміло, що Lk в результаті роботи топоізомерази змінюється на величину, кратну одиниці, − на кількість обертів.
Таким чином, топоізомерази І обох типів змінюють число зчеплень шляхом зміни твіста подвійної спіралі. Іншою спільною ознакою топоізомераз І є незалежність їхньої активності від АТР: відновлення цілісності полінуклеотидного ланцюга відбувається після тимчасового ковалентного пришивання одного з кінців до активного центру ферменту й не потребує зовнішніх джерел вільної енергії.
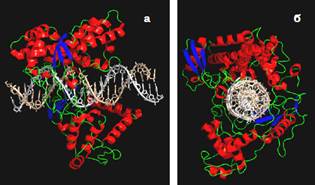
Рис. 27. Еукаріотична топоізомераза І у комплексі з ДНК у двох проекціях (1K4S).
Топоізомерази ІІ, на відміну від топоізомераз першого класу, змінюють число зчеплень шляхом зміни райзингу циркулярної ДНК.
Є й дві інші відмінності: ці субодиничні білки мають два активні центри, в яких відбувається розрізання обох полінуклеотидних ланцюгів; фермент є активним тільки у присутності АТР, гідроліз якої використовується для здійснення конформаційних змін білка. Структурні домени двох субодиниць еукаріотичної топоізомерази ІІ (рис. 28) або чотири субодиниці прокаріотичних топоізомераз цього типу утворюють своєрідні верхні та нижні «ворота», які здатні розкриватися та закриватися при структурних перебудовах.
Схему роботи топоізомерази ІІ зображено на рис. 29: 1) ділянка ДНК, яка називається G-сегментом, зв’язується з ферментом, що викликає спорідненість ферменту до АТР; 2) у відповідь на зв’язування АТР відбувається конформаційна зміна, яка супроводжується замиканням іншої зв’язаної ділянки ДНК – Т-сегмента, і дволанцюговим розривом у складі G-сегмента; 3) відбувається гідроліз АТР, що приводить до проштовхування Т-сегмента крізь розрив; 4) здійснюється зшивання розриву та звільнення обох сегментів. Шляхом описаної операції можна перетворити, наприклад, одну надспіралізовану молекулу на рис. 24 в іншу, звідки зрозуміло, що число зчеплень при роботі топоізомераз ІІ змінюється на величину, кратну двом.
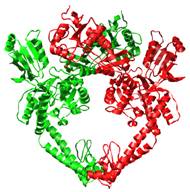
Рис. 28. Еукаріотична топоізомераза ІІ (1BJT).
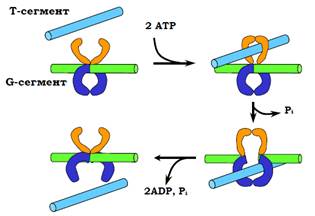
Рис. 29. Схема дії топоізомерази ІІ.
Напрямок зміни Lk залежить від взаємної орієнтації G- і Т-сегментів. Еукаріотичні топоізомерази ІІ дозволяють обидві орієнтації: у результаті Lk змінюється в напрямку релаксації ДНК. Але до класу топоізомераз ІІ належить також бактеріальний фермент – гіраза (gyrase), який допускає тільки одну орієнтацію – її зображено на рис. 29. Результатом роботи гірази є зміна Lk тільки в одному напрямку – накопичення негативної надспіралізації. Це має важливі функціональні наслідки, оскільки сприяє дестабілізації подвійної спіралі ДНК на певних важливих ділянках.
Дата добавления: 2015-09-11; просмотров: 1610;
