Структура. Інший тип регулярної вторинної структури, який часто зустрічається в білках, − це β-структура
Інший тип регулярної вторинної структури, який часто зустрічається в білках, − це β-структура. Вона складається з витягнутих фрагментів поліпептидного ланцюга: кілька таких фрагментів – β-тяжів (βstrands) − утворюють β−структурний шар, у площині якого розташовані водневі зв’язки між пептидними групами тяжів, а від обох поверхонь відходять амінокислотні залишки (рис. 6).
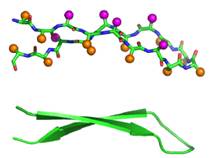
Рис. 6. Антипаралельна β-структурна шпилька (амінокислотні залишки зображено кульками, як на рис. 5). Унизу: та сама шпилька в загальноприйнятому схематичному зображенні.
Половина пептидних груп β-тяжів, які містяться на межах шару, залишаються ненасиченими водневими зв’язками. Тому чим більше тяжів входить до складу шару, тим більш стабільним він є. β-Шар може бути антипаралельним (сусідні тяжі спрямовані у протилежні один щодо одного напрямки, як на рис. 6) або паралельним (звичайно, якщо тяжі не розташовані один за одним по ланцюгу).
Як видно з рис. 6, β-шар завжди є дещо скрученим через те, що окремі тяжі не є абсолютно прямими.
Сусідні по ланцюгу амінокислотні залишки розташовані по різні боки β-структурного шару. І знову спостерігається вже зрозуміла закономірність: принаймні одна поверхня шару є переважно гідрофобною.
Спіраль 310
Права спіраль 310 (водневий зв’язок між і та і + 3 залишками) зустрічається не дуже часто у вигляді коротких (три-чотири залишки) фрагментів.
Дата добавления: 2015-09-11; просмотров: 697;
