Спіраль
Одна з допустимих конформацій на карті Рамачандрана (φ = 60°, ψ = 45°, рис. 4) передбачає наближення оксигену пептидної групи і-го залишку до NH-групи і + 4. Перша група є акцептором водневого зв’язку, друга − донором. Система таких водневих зв’язків між кожним і та і + 4 залишком стабілізує регулярну конформацію, яка й називається α-спіраллю (рис. 5). Ця спіраль є правою (точка, що рухається вздовж ланцюга, обертається навкруг осі спіралі за годинниковою стрілкою й одночасно пересувається вздовж осі вперед), на один виток припадає 3,6 амінокислотного залишку, одного витка вздовж осі (крок спіралі) 5,4 Å. Водневий зв’язок між пептидними групами замикає в кільце 13 атомів чотирьох залишків: відповідно, α-спіраль позначається також як спіраль 413. α-Спіраль можна приблизно уявити як циліндр діаметром ≈ 10 Å, на поверхні якого розташовані амінокислотні залишки.
Оскільки найімовірніша локальна конформація ланцюга залежить від послідовності, різні амінокислоти та їхні комбінації мають різний потенціал щодо включення в α-спіраль (як і в будь-яку іншу вторинну структуру). Наприклад, Pro не може бути включеним до α-спіралі (немає донора водневого зв’язку). Gly також уникає регулярних структур, оскільки втратив би свою високу конформаційну свободу (ентропійна ціна була б надто високою). При цьому в глобулярних білках спостерігається закономірність: гідрофобні амінокислотні залишки згруповані на поверхні спіралі в більш менш суцільний гідрофобний кластер (рис. 5). Тобто, α-спіраль переважно утворюється на таких ділянках послідовності з високим спіральним потенціалом, які здатні сформувати гідрофобний кластер на поверхні спіралі.
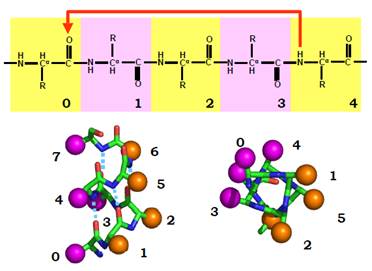
Рис. 5. α-Спіраль. Червона стрілочка − водневий зв’язок. Унизу: дві проекції α-спіралі, пунктирні лінії − водневі зв’язки між пептидними групами. Бокові залишки показані схематично, різне забарвлення символізує два типи залишків − полярні й неполярні.
Така закономірність пояснюється просто. Унаслідок конкуренції з молекулами води водневі зв’язки між пептидними групами (а отже, і спіраль) у водному оточенні не є дуже стабільними. Адже утворення спіралі коштує енергетичних витрат − зниження ентропії за рахунок обмеження конформаційної свободи. А водневі зв’язки у присутності води (тобто заміна зв’язку між пептидною групою та водою на зв’язок між пептидними групами) не здатні суттєво компенсувати ці витрати. Якщо ж на поверхні спіралі є гідрофобний кластер, він прагне адсорбувати іншу гідрофобну поверхню (спіралі чи інших елементів вторинної структури). Тоді частина пептидних груп і водневих зв’язків між ним опиняється в неполярному оточенні, що суттєво стабілізує і ці зв’язки, і α-спіраль. У результаті у глобулі залишаються лише α-спіралі з гідрофобним кластером на поверхні. Це вказує, що формування регулярної вторинної структури та укладання в глобулу − єдиний процес. Нижче при обговоренні глобулярної структури ми розглянемо питання про те, чому взагалі утворюється регулярна вторинна структура в глобулярних білках.
Дата добавления: 2015-09-11; просмотров: 1043;
