Електростатичні (іонні) взаємодії
Певні хімічні групи в біологічних макромолекулах здатні іонізуватися, тобто набувати постійного негативного чи позитивного заряду, втрачаючи чи набуваючи протон. Взаємодія між такими зарядами підпорядковується добре відомому закону Кулона (Charles de Coulomb), а саме, вільна енергія взаємодії двох зарядів q1 і q2 залежить від відстані між зарядами r як
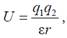
де ε – діелектрична проникність середовища.
При цьому слід звернути увагу на кілька досить важливих моментів. Величина ε залежить від полярності середовища. Поляризованість молекул води призводить до досить великого значення проникності(ε ≈ 80 за кімнатної температури). У неполярному середовищі проникність є значно нижчою (наприклад, усередині молекули білка ε ≈ 3) і, відповідно, електростатична енергія зростає. Занурення зарядженої групи або навіть пари наближених різнойменних зарядів у неполярне середовище є дуже невигідним енергетично: заряджені групи частіше залишаються на поверхні макромолекул, не занурюючись усередину.
Висока діелектрична проникність води свідчить про те, що електростатичні взаємодії у воді пов’язані в першу чергу з упорядкованістю диполів води навкруг зарядів і зміною цієї впорядкованості при наближенні чи віддаленні зарядів. Тобто електростатичні взаємодії мають ентропійну природу – при наближенні (взаємній нейтралізації) різнойменних зарядів ступінь упорядкованості диполів води знижується. Відповідно, зростає ентропія і знижується вільна енергія.
Найвагомішими електростатичні взаємодії є для макромолекул, на поверхні яких сконцентрована велика кількість заряджених груп. На перший погляд здається очевидним, що дві макромолекули з позитивно та негативно зарядженими поверхнями мають взаємодіяти за законом Кулона. Але крім води в живих системах завжди присутні неорганічні іони, які, за тим самим законом Кулона, мають зв’язуватись із зарядженими поверхнями макромолекул (рис. 8). Права частина рис. 8 енергетично краща за ліву лише одним, а саме звільненням неорганічних іонів у зовнішній розчин, тобто більш низькою впорядкованістю (вищою ентропією та нижчою вільною енергією).
Таким чином, взаємодія двох заряджених макромолекул – цілком ентропійний ефект. Величина цього ефекту знижується зі зростанням концентрації неорганічних іонів (іонною силою): якщо іонів досить багато в зовнішньому розчині, ефект від їхнього звільнення є дуже незначний. Тоді взаємна спорідненість макромолекул знижується і комплекс дисоціює.
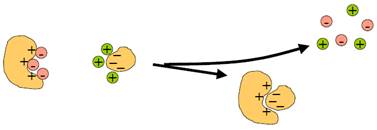
Рис. 8. Ентропійна природа електростатичних взаємодій між високозарядженими макромолекулами.
Дата добавления: 2015-09-11; просмотров: 1315;
