Перебудови системи ковалентних зв'язків у хімічних реакціях
Хімічну реакцію можна визначити як процес перебудови системи ковалентних зв’язків у межах однієї молекули чи групи молекул (субстрати реакції) з утворенням нових молекул продуктів. Варто зауважити, що ковалентний зв’язок практично ніколи не руйнується в хімічних реакціях (це дуже невигідно енергетично) – він просто замінюється на зв’язок з іншим атомом. Перший принцип, який уже було сформульовано, полягає в тому, що реакція відбувається тоді й тільки тоді, коли вільна енергія продуктів реакції є нижчою, ніж вільна енергія субстратів (рис. 6).
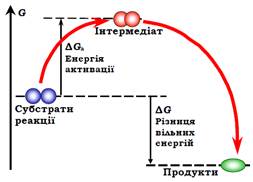
Рис. 6. Енергетична схема процесу хімічної реакції.
Ця умова є лише необхідною, але не достатньою. Оскільки кожна молекула вже існує в мінімумі вільної енергії (система ковалентних зв’язків є дуже стабільною), на шляху перебудови електронної щільності неодмінно має існувати перехідний стан (інтермедіат) з більш високою енергією. Це означає, що електронну систему субстратів необхідно спочатку збудити, відхиливши її від рівноважного стабільного стану, після чого вона автоматично впаде в стан продуктів, оскільки цей стан знаходиться нижче на шкалі вільної енергії. Отже, енергія інтермедіатного стану неодмінно є вищою за енергію субстратів: наявність інтермедіату створює на шляху кожної хімічної реакції енергетичний бар’єр, величина якого називається енергією активації (рис. 6). При цьому вільна енергія активації містить також ентропійну складову: реакція відбувається тільки тоді, коли субстрати стикаються в певній взаємній орієнтації – лише в одній із великої кількості орієнтацій при випадкових стиканнях. Тобто малоймовірна подія є передумовою утворення інтермедіату – різниця ентропії між інтермедіатом і субстратами (ентропія активації) є негативною величиною, тобто дає позитивний внесок у вільну енергію активації.
Енергія активації, згідно з принципом Больцмана (рівняння (1.1)), визначає імовірність переходу в інтермедіатний стан, тобто швидкість реакції. Великий (порівняно з тепловою енергією kBT) енергетичний бар’єр означає, що реакція уповільнюється настільки, що практично не відбувається. Найпростіший шлях прискорити реакцію – підвищити температуру (збільшити енергію теплового руху). Зрозуміло, що в живих системах таке рішення є неможливим.
Кожна хімічна реакція, яка відбувається в клітині, потребує (для того, щоб вона могла відбуватися за розумний час) спеціального молекулярного пристрою – каталізатора, який прискорює реакцію за рахунок зниження енергії активації. Роль біокаталізаторів виконують у більшості випадків (але не завжди) білкові ферменти (ензими).
Дата добавления: 2015-09-11; просмотров: 808;
