Водневий зв'язок
Розглянемо дві молекули води (рис. 9). Унаслідок високої електронегативності оксигену молекула води є полярною, тобто на її атомах присутні парціальні електричні заряди (приблизно –2/3 заряду електрона на оксигені, +1/3 на кожному гідрогені). Відповідно, дві молекули будуть взаємодіяти одна з одною електростатично. Але тут є ще дві важливі обставини:
1) атом гідрогену має лише один електрон, і цей електрон є відтягнутим на оксиген у молекулі води;
2) атомок сигену містить на зовнішньому шарі неподілену пару електронів (рис. 3), які не залучені до утворення ковалентного зв’язку.
У результаті слабка електронна оболонка гідрогену продавлюється атомом оксигену другої молекули; його неподілена пара електронів частково узагальнюється з гідрогеном, електрон якого є відтягнутим власним оксигеном. Взаємодія такого типу й називається водневим зв’язком, який, являє собою дещо середнє між електростатичною взаємодією (притягання парціальних зарядів) і ковалентним зв’язком (часткове узагальнення пари електронів між двома атомами).
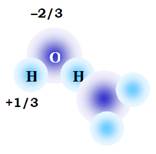
Рис. 9. Дві молекули води, зв’язані водневим зв’язком.
Типові пари хімічних груп, що утворюють водневі зв’язки в макромолекулах:
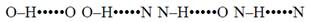
Тобто водневий зв’язок утворюється між атомом гідрогену, приєднаним до електронегативного атома з частковим негативним зарядом δ– (ця група віддає протон і називається донором водневого зв’язку) та електронегативним атомом іншої хімічної групи чи молекули (акцептором), який містить неподілену пару електронів:

Група С – Н, наприклад, не відповідає цим принципам (зв’язок С – Н неполярний, оскільки С не є електронегативним атомом) і не може бути залученою до утворення водневого зв’язку.
Дві властивості водневого зв’язку є наслідком його природи:
• Водневий зв’язок є дуже вигідним енергетично: його енергію (утворення водневого зв’язку супроводжується виділенням тепла, тобто він має ентальпійну природу) можна оцінити приблизно в 5 ккал/моль (порівняйте з енергією теплового руху RT = 0,6 ккал/моль).
• На відміну від електростатичних взаємодій, але так само, як ковалентний зв’язок, водневий зв’язок є чутливим до взаємної орієнтації донора й акцептора. Особливо це стосується напрямку донорної групи: ковалентний зв’язок D – H має бути спрямованим на акцепторний атом (припустиме відхилення зв’язку від напрямку водневого зв’язку становить 20 – 30°). Друга властивість є дуже важливою. Вона означає, що водневі зв’язки між макромолекулами утворюються тільки тоді, коли між донорними та акцепторними групами є чітка просторова відповідність. Це робить водневий зв’язок найсуттєвішим фактором у визначенні специфічності міжмолекулярних взаємодій – міжмолекулярному впізнанні.
Перша властивість також потребує уточнень. Якщо взаємодія між донором і акцептором відбувається у водному середовищі, то рівняння (1.7) має бути переписане таким чином:
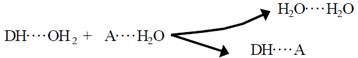 .
.
Як бачимо, кількість водневих зв’язків є однаковою ліворучі праворуч (ентальпія системи не змінюється), різною може бути лише ентропія лівого та правого станів. Якщо донор і акцептор – маленькі молекули, то переважним буде лівий стан (велика кількість молекул води робить його менш упорядкованим): маленькі полярні молекули розчиняються у воді, тому що добре з нею взаємодіють. Якщо донорі акцептор належать макромолекулі, переважним може стати правий стан: пара молекул води може вільніше рухатися, що збільшує ентропію системи.
Отже, водневі зв’язки у водному середовищі мають ентропійну природу. Зрозуміло, що в неполярному середовищі (де немає конкуренції з водою) водневий зв’язок буде значно стабільнішим.
Дата добавления: 2015-09-11; просмотров: 1113;
