Властивості ковалентного зв'язку
Ковалентний (або хімічний) зв’язок – це єдина сила, що підтримує цілісність певної системи атомів, яка називається молекулою. Основою утворення ковалентного зв’язку є узагальнення електронів двох атомів – ефект, що описується у квантовій механіці. Результатом узагальнення є формування так званої молекулярної орбіталі, яка належить двом атомам одночасно й на якій може міститися не більше двох електронів (принцип заборони Паулі (Wolfgang Pauli)).
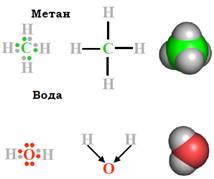
Рис. 3. Структура молекул метану й води. Показано пари електронів, які відповідають ковалентним зв’язкам. Стрілки символізують зсув електронної щільності до атома оксисену.
Наприклад, на зовнішньому електронному шарі атома карбону знаходиться 4 електрони (рис. 3), максимально в цьому шарі може бути 8 електронів. Він доповнюється електронами чотирьох атомів гідрогену (по одному електрону на кожному атомі), і в результаті утворюється молекула метану. Аналогічно доповнення зовнішнього шару оксигену за рахунок двох атомів гідрогену призводить до утворення молекули води (рис. 3). Між двома атомами, залежно від їхньої природи, можливо також формування двох (іноді й трьох) молекулярних орбіталей (по два електрони на кожній), тобто утворення подвійного (чи потрійного) ковалентного зв’язку.
Головні властивості ковалентного зв’язку:
• Ковалентний зв’язок дуже міцний. Інакше кажучи, кожна молекула (про це говорить сам факт її існування) знаходиться в досить глибокій потенційній ямі – мінімумі вільної енергії.
• Кожен атом містить певну кількість електронів, які можуть бути узагальненими з іншими атомами (або вакансій для електронів на зовнішньому шарі). Тобто кожен атом може утворити лише певну кількість ковалентних зв’язків – має певну валентність (наприклад, валентність карбону дорівнює 4,оксигену – 2, гідрогену – 1.
• Ковалентний зв’язок характеризується певною геометрією. По-перше, кожен зв’язок має конкретну довжину (зазвичай 1 – 2 Å). По-друге, електронні щільності різних орбіталей у молекулі взаємодіють між собою, і в результаті кожен зв’язок певним чином орієнтований у просторі відносно суміжних зв’язків. Типові значення валентних кутів (кутів між зв’язками, що йдуть від одного атома) становлять близько 109° або 120°.Слід також зауважити, що ступінь узагальнення електронної пари між двома атомами залежить від природи цих атомів. Наприклад, у випадку зв’язку С – Н електронна щільність розподілена приблизно рівномірно між двома атомами. Такий зв’язок називають неполяризованим. У випадку зв’язку О – Н, унаслідок високої електронегативності оксигену (здатності відтягувати на себе електронну щільність), електронна пара зсунута до цього атома (поляризований зв’язок показано стрілками на рис. 3). У результаті в молекулі води на оксигені виникає парціальний негативний (приблизно –2/3 від заряду електрона), а на кожному гідрогені позитивний (+1/3) заряд. Іншим важливим для біополімерів прикладом електронегативного атому є азот.
Дата добавления: 2015-09-11; просмотров: 1411;
