Робота № 4/2. Визначення теплоти нейтралізації калориметричним методом
Мета роботи. Визначити теплоту реакції нейтралізації соляної кислоти лугом методом калориметрії.
Методика роботи. Дослідним шляхом показано, що нейтралізація 1 моль-екв. будь-якої сильної кислоти сильною основою в розведених розчинах завжди супроводжуються майже одним і тим самим екзотермічним тепловим ефектом, що дорівнює 56,9 кДж/моль-екв. З позиції теорії електролітичної дисоціації даний факт пояснюється тим, що в розведених розчинах реакція нейтралізації зводиться лише до утворення молекули води із іонів Н+ та ОН-:

або в іонній формі
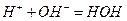
Якщо ж нейтралізується слабка кислота сильною основою, або навпаки, тепловий ефект може бути як більшим, так і меншим від величини 56,9 кДж/моль-екв. Це пов'язано з тим, що ступінь дисоціації таких кислот або основ є незначним і процес нейтралізації одночасно супроводжується процесом дисоціації слабкої кислоти (основи) на іони. Тому 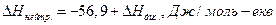 .
.
Наприклад, для випадку нейтралізації розчину слабкої оцтової кислоти розчином сильної основи (NaOH) будуть одночасно мати місце такі процеси:
 ; DНдис.
; DНдис.
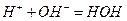 (рід); DHнейтр.
(рід); DHнейтр.
-----------------------------------------------------------------------------
 (рід); DН,
(рід); DН,
де
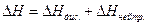
Порядок роботи. При змішуванні розчинів кислоти і лугу, поряд з нейтралізацією, йде розведення розчину. Тепловий ефект, який визначається при проведенні досліду (DН), є сумарною величиною
 .
.
Для нейтралізації беруть невеликий надлишок основи, щоб повністю нейтралізувати кислоту. Якщо вихідна концентрація кислоти є в декілька разів більшою за концентрацію лугу, то величиною DНрозб. лугу можна знехтувати і прийняти, що
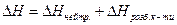 . (1)
. (1)
Опис калориметричного пристрою і порядок роботи з ним наведено у роботі № 4/1. Спочатку, як завжди, визначається стала калориметра С.
Для проведення експерименту треба приготувати 4 н розчин кислоти і знайти теплоту її розведення в калориметрі. При цьому в зважену ампулу з пробійником внести 15 мл такого розчину і знайти його масу за різницею маси ампули з кислотою і без неї. Розрахувати точний об'єм V кислоти за її густиною. У калориметричну склянку налити 350 мл дистильованої води, зібрати калориметр, помістити ампулу у відповідний отвір кришки. Провести дослід так, як це описано в роботі № 4/1.
Теплоту розведення 1 моль-екв. кислоти розрахувати за рівнянням:
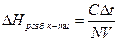 , (2)
, (2)
де N - нормальність кислоти.
Після цього калориметр розібрати і промити всі його частини дистильованою водою. У калориметричну склянку налити 350 мл 0,2 н розчину КОН. Взяти таку саму наважку кислоти, як при визначенні теплоти її розведення, і провести дослід аналогічно попередньому. За рівнянням (2) розрахувати сумарний тепловий ефект. За рівнянням (1) обчислити DHнейтр.. Значення DНрозб.к-ти треба визначити з урахуванням сумарної теплоти нейтралізації, що спостерігається в експерименті (реакція ендотермічна).
Література: [ 20-23].
Дата добавления: 2015-09-11; просмотров: 793;
