СВОЙСТВА ФЕРМЕНТОВ
Цель занятия: 1.Повторить материал по физико-химическим
свойствам белков.
2.Ознакомиться с современными представлениями о структу-
ре ферментов, изучить их характерные свойства.
Исходный уровень знаний:
- строение и физико-химические свойства белков;
- понятие о катализаторах.
Содержание занятия.
I.2. Понятие о катализе.
Химическая природа ферментов.
Свойства ферментов.
Строение ферментов (функциональные центры, их строение).
Факторы, определяющие активность ферментов.
Витамины как коферменты.
Понятие об изоферментах.
Мультимолекулярные ферментные системы.
II.1.Работа № 1.ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА
АКТИВНОСТЬ АМИЛАЗЫ СЛЮНЫ
Принцип метода и химизм.
Амилаза слюны (a-1,4-гликозидаза) катализирует гидролиз a-1,4-гликозидной связи крахмала и гликогена до дисахарида мальтозы с промежуточным образованием декстринов различного размера. Нерасщепленный крахмал с йодом дает синее окрашивание, амилодекстрины - фиолетовое, эритродекстрины - красно-бурое, ахродекстрины и мальтоза - желтое (цвет водного раствора йода, т.е. окрашивания с йодом не дают). Конечные продукты гидролиза крахмала - мальтоза и глюкоза - имеют свободную альдегидную группу и могут быть обнаружены реакцией Троммера, в основе которой лежит окислительно-восстановительная реакция. При нагревании альдегидная группа окисляется до глюконовой кислоты, а медь гидрата окиси меди (голубого цвета) - восстанавливается в гидрат закиси меди (желтого цвета). При дальнейшем нагревании образуется красная закись меди:
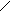
 H O
H O

 C=O + 2CuSO4 + 5NaOН ® C–O–Na + 2CuOH + 2Na2SO4 + 2H2O
C=O + 2CuSO4 + 5NaOН ® C–O–Na + 2CuOH + 2Na2SO4 + 2H2O
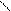
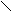 R R
R R
Одним из характерных свойств ферментов является термолабильность, т.е. чувствительность фермента к температуре. Для многих ферментов максимальная ферментативная скорость наблюдается при 38-400C. Эта температура называется температурным оптимумом. При нагревании свыше 700С они утрачивают свои свойства биологических катализаторов. Степень инактивирования зависит от длительности теплового воздействия. Замедление и прекращение ферментативной реакции происходит вследствие тепловой денатурации белковой молекулы фермента. При низких температурах ферменты не денатурируются, но скорость реакции резко снижается за счет снижения кинетической энергии молекул. О действии фермента судят по исчезновению субстрата или появлению продуктов реакции.
Порядок выполнения работы:
В чистую пробирку собрать примерно 2 мл нативной (неразведенной) слюны и кипятить в течение 5 минут, охладить.
| Реагенты (кап.) | Пробирки | ||
| 1-я | 2-я | 3-я | |
| 1% раствор крахмала | |||
| Нативная слюна, разведенная в 10 раз | - | - | |
| Прокипяченная неразведенная слюна | - | - | |
| Дистиллированная вода | - | - | |
| Поместить в термостат при 380С на 10 мин. Из содержимого каждой пробирки отлить по 5 капель в дополнительные пробирки. а) йодная проба (на крахмал) | |||
| Реагенты (кап.) | Пробирки | ||
| 1-а | 2-а | 3-а | |
| Исследуемый раствор | |||
| Раствор йода в йодистом калии | |||
| РЕЗУЛЬТАТЫ: | |||
| б) реакция Троммера (на глюкозу и мальтозу) | |||
| Реагенты (кап.) | 1-б | 2-б | 3-б |
| Исследуемый раствор | |||
| 10% раствор NаОН | |||
| 1% раствор CuSO4 | |||
| РЕЗУЛЬТАТЫ: |
ВЫВОД:
Работа № 2. ВЛИЯНИЕ РЕАКЦИИ СРЕДЫ НА АКТИВ-
НОСТЬ ФЕРМЕНТОВ И ОПРЕДЕЛЕНИЕ
ОПТИМУМА рН
Принцип метода и химизм.
Для разных ферментов существует свой оптимум рН среды, когда фермент наиболее активен. Например, оптимум рН пепсина (фермент желудочного сока) - 1,5-2,0; аргиназы (фермент печени) - 9,5. Для амилазы слюны оптимум рН - 6,8-7.2; в кислой и щелочной среде активность ее снижается за счет взаимодействия белковой молекулы с ионами раствора.
Химизм реакции см. выше (раб. N1).
Порядок выполнения работы:
Слюну развести в 10 раз. Взять 5 пробирок и приготовить смеси в соответствии с таблицей (все растворы берутся в каплях).
| Реактивы | Пробирки | ||||
| 1 | 2 | 3 | 4 | 5 | |
| раствор 1 | |||||
| раствор 2 | |||||
| 1% раствор NaCl | |||||
| рН | 5,8 | 6,9 | 7,4 | 7,9 | 8,5 |
| 0,5% раствор крахмала | |||||
| Слюна разведенная | |||||
| Перемешать, поместить в термостат при температуре 380С на 10 минут | |||||
| раствор йода | |||||
| Окраска | |||||
| Продукты гидролиза крахмала |
ВЫВОД:
Дата добавления: 2015-09-11; просмотров: 1003;
