КЛАССИФИКАЦИЯ БЕЛКОВ. ХИМИЯ ПРОСТЫХ И
СЛОЖНЫХ БЕЛКОВ. МЕТОДЫ ОСАЖДЕНИЯ БЕЛКОВ
Цель занятия: 1.Ознакомиться с классификацией белков, харак-
теристиками отдельных групп белков и пептидов.
2.Освоить методы осаждения белков.
Исходный уровень знаний:
- строение и свойства белков;
- биологическая роль белков.
Содержание занятия.
I.2. Характеристика основных групп простых белков.
Принцип классификации сложных белков.
Характеристика природных пептидов.
Содержание белков и аминокислот в крови в норме и при патологии.
I.3. Контрольная работа.
СВОДНЫЕ ВОПРОСЫ К КОНТРОЛЬНОЙ РАБОТЕ
ПО РАЗДЕЛУ "СТРОЕНИЕ И СВОЙСТВА БЕЛКОВ"
1. Определение класса белков. Элементарный состав, наименьшая структурная единица, молекулярная масса белков.
2. Классификация аминокислот, входящих в состав белков, основанная на полярности радикалов; примеры неполярных, полярных, положительно- и отрицательно заряженных аминокислот.
3. Амфотерность и растворимость аминокислот. Функциональные группы аминокислот, участвующие в образовании ковалентных, ионных, электростатических и гидрофобных (Ван-дер-Ваальса) связей белковой молекулы.
4. Структура и название аминокислот, производных пропионовой, масляной, валериановой, капроновой, янтарной и глутаровой кислот.
5. Структура и название окси- и серусодержащих, гомо- и гетероциклических аминокислот.
6. Факторы, удерживающие белок в растворе. Изоэлектрическая точка белков. Методы осаждения белков, значение для медицины. Обратимое и необратимое осаждение. Примеры.
7. Основные физико-химические свойства белков. Свойства коллоидных растворов, отличительные от свойств истинных растворов. Методы выделения и очистки белков. Диализ, значение для медицины.
8. Методы обнаружения белков в растворе и изучения качественного состава белка. Гидролиз белка, виды гидролиза, промежуточные и конечные продукты. Применение белковых гидролизатов в лечебной практике.
9. Назовите трипептид, например:
H3C-CH-CH2-CH-CO-NH-CH-CO-NH-CH-COOH
| | | |
CH3 NH2 CH3 CH2
|
CH2-S-CH3
 |  | ||

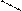 -CH2-CH-CO-NH-CH-CO-N
-CH2-CH-CO-NH-CH-CO-N
 | | |
| | |
NH2 (CH2)3 COOH
|
CH2NH2
10. Напишите трипептид: а) глицил-валил-изолейцин;
б) лейцил-тирозил-гистидин; в) аланил-метионил-триптофан и т.п.
11. Белки - основа жизненных процессов. Значение работ А.Я.Данилевского, Э.Фишера, Л.Полинга в формировании представлений о строении белков. Уровни структурной организации белковой молекулы.
12. Первичная структура, формирующие её связи. Зависимость биологических свойств белков от характера аминокислотной последовательности в полипептидной цепи ( HbA, HbS ).
13. Конформация пептидных цепей в белках: вторичная и третичная структуры, связи, определяющие эти структуры. Об-ратимая и необратимая денатурация белков; причины, значение.
14. Высшая форма организации белковой молекулы - четвертичная структура. Кооперативные изменения конформации протомеров (на примере гемоглобина и миоглобина).
15. Зависимость функциональных свойств белков от их конформации. Способность к специфическим взаимодействиям ("узнавание") как основа функционирования всех белков. Антигенные свойства белков.
16. Биологические функции белков. Различия белкового состава органов. Изменение белкового состава при онтогенезе и болезнях.
17. Классификация белков. Химия сложных белков. Важ-нейшие представители простых и сложных белков в организме человека.
18. Структурные белки. Классификация, особенности строения, распределение в тканях. Самосборка многомолекулярных белковых структур на примере коллагеновых волокон.
II.1. Работа № 1. ОСАЖДЕНИЕ БЕЛКОВ ПРИ КИПЯЧЕНИИ
Принцип метода основан на денатурации большинства белков при нагревании их растворов при температуре свыше 5О-6О0С, что приводит к потере растворимости, особенно в изоэлектрической точке.
Почти все белки свертываются и осаждаются при нагревании в нейтральной и слабокислой среде. В сильнокислых и щелочных средах растворы белков при кипячении денатурируют, но не коагулируют и могут дать осадок лишь при добавлении достаточного количества какой-либо нейтральной соли (NaCl, сернокислый аммоний и др.). Устойчивость белка в растворе зависит от приобретения (+) заряда в случае сильнокислой среды и усиления (-) заряда в щелочной среде.
+H+ -H+

 H3N+-CH-COOH H3N+-CH-COO- H2N-CH-COO-
H3N+-CH-COOH H3N+-CH-COO- H2N-CH-COO-
| | |
 R R R
R R R
молекула заряжена цвиттерионная молекула заряжена
"+" форма аминокислоты "-"
рН = 2-3 рН = 4-9 рН = 9-10
(биполярная форма)
При понижении рН диссоциация карбоксильной группы подавляется и молекула становится положительно заряженной. При повышении pH происходит отрыв связанного протона аминокислоты и молекула приобретает отрицательный заряд. Более полное и быстрое осаждение происходит при достижении изоэлектрической точки. Изоэлектрической точкой называют такое значение рН, при котором суммарный электрический заряд белка равен нулю и, следовательно, белок при этом в электрическом поле теряет подвижность, т.е. остается на старте. Для большинства белков изоэлектрическая точка соответствует слабокислой среде (в пределах от 5,5 до 6,9).
Итак, важную роль в денатурации белков при нагревании играет концентрация водородных ионов, т.е. определенная реакция среды, и присутствие солей.
Порядок выполнения работы:
| Реактивы (кап.) | Пробирки | ||||
| 1 | 2 | 3 | 4 | 5 | |
| 1% раствор яичного белка | |||||
| 1% раствор CH3COOH | - | - | |||
| насыщенный раст-вор NaCl | - | - | - | - | |
| 10% раствор NaOH | - | - | - | - | |
| КИПЯЧЕНИЕ | |||||
| Реакция среды | Нейт-ральная | слабо-кислая | сильнокислая | сильнокислая, + электролит | щело-чная |
| РЕЗУЛЬТАТЫ: |
ВЫВОД:
Работа № 2a. ОСАЖДЕНИЕ БЕЛКОВ СОЛЯМИ
ТЯЖЕЛЫХ МЕТАЛЛОВ
Принцип метода.
Осаждение белков солями тяжелых металлов в отличие от высаливания происходит при небольших концентрациях солей. Белки при взаимодействии с солями тяжелых металлов (свинца, меди, серебра, ртути и др.) адсорбируют их, образуя солеобразные и комплексные соединения, растворимые в избытке этих солей (за исключением солей AgNO3, HgCl2), но нерастворимые в воде.
Растворение осадка в избытке солей называется адсорбционной пептизацией. Данное явление происходит вследствие возникновения одноименного (+) заряда на частицах белка. Способность белка прочно связывать ионы тяжелых металлов в виде нерастворимых осадков в воде используется как противоядие при отравлении солями ртути, меди, свинца и др. Обычно применяют белки молока и яиц сразу после отравления, пока эти соли еще находятся в желудке и не успели всосаться. Вслед за введением белка у больного вызывают рвоту, чтобы удалить остатки яда из организма.
Порядок выполнения работы.
| Реактивы (кап.) | Пробирки | ||
| 1 | 2 | 3 | |
| а) Раствор яичного белка | |||
| 1% раствор CuSO4 | - | - | |
| 5% раствор Pb(CH3COO)2 | - | - | |
| 5% pаствор AgNO3 | - | - | |
| РЕЗУЛЬТАТЫ: | |||
| б) продолжение опыта в тех же пробирках (добавить) | |||
| 1% раствор CuSO4 | 5-10 | - | - |
| 5% pаствоp Pb(CH3COO)2 | - | 5-10 | - |
| 5% pаствоp AgNO3 | - | - | 5-10 |
| РЕЗУЛЬТАТЫ: |
ВЫВОД:
Работа № 2б. ОСАЖДЕНИЕ БЕЛКОВ КОНЦЕНТРИРОВАН-
НЫМИ МИНЕРАЛЬНЫМИ КИСЛОТАМИ
Принцип метода.
Концентрированные минеральные кислоты вызывают денатурацию белка и образуют комплексные соли белка с кислотами. В избытке всех минеральных кислот, за исключением азотной, выпавший осадок белка растворяется. Качественная реакция с концентрированной HNО3 лежит в основе количественного определения белка в моче по методу Робертса-Столь-никова-Брендберга.
Порядок выполнения работы:
| Реактивы (кап.) | I этап | II этап | ||
| Пробирки | ||||
| Концентрированная HNO3 | - | - | ||
| Концентрированная H2SO4 | - | - | ||
| Раствор белка | - | - | ||
| Примечание: Раствор белка осторожно наслоить на кислоту по стенке пробирки, наклоненной под углом 450. | ||||
| РЕЗУЛЬТАТЫ: |
ВЫВОД:
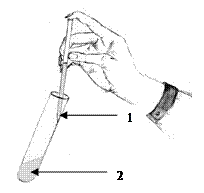 |
Рис. 2. Наслаивание пробы на концентрированную кислоту:
1 -раствор белка; 2-кислота.
III.2. Контрольные вопросы.
Какие факторы удерживают белки в растворе?
Чем обусловлена реакция осаждения белков?
Что такое коагуляция белков? Виды коагуляции.
Что такое денатурация белка? Виды денатурации.
При каких условиях происходит: коагуляция
с денатурацией; коагуляция без денатурации;
денатурация без коагуляции?
Что такое адсорбционная пептизация?
Как используется в медицине реакция адсорбционной
пептизации?
Материал для самоподготовки: I а)1. с.19-74, 662-565. II, III.
РАЗДЕЛ II. ФЕРМЕНТЫ
Дата добавления: 2015-09-11; просмотров: 2212;
