ОСОБЕННОСТИ РАЗВИТИЯ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ В ПРОИЗВОДСТВЕННЫХ УСЛОВИЯХ
Несмотря на совершенствование специфической профилактики, средств иммунного модулирования и защиты, системы мер по недопущению и борьбе с бактериальными и вирусными болезнями, проблема сохранности и снижения заболеваемости молодняка сельскохозяйственных животных остается одной из самых актуальных.
Стадию новорожденности телят, поросят, козлят, ягнят, жеребят, верблюжат, пыжиков, крольчат, молодняка других видов характеризуют неустойчивость в работе многих органов и систем, повышенная ранимость организма, недостаточность ритмики кровообращения и дыхания, функций пищеварения и защиты. Поэтому неонатальные животные нуждаются в особом внимании и заботе.
В период адаптации новорожденного организма к новым условиям происходит активизация структурной организации клеток и тканей наиболее ответственных систем, обеспечивающих жизнедеятельность. Неполноценность структурной организации органов пищеварительной, эндокринной, иммунной и других систем организма новорожденного предопределяет возникновение патологии.
В условиях промышленного животноводства, особенно крупных комплексов и хозяйств, индивидуальное внимание к животным недостаточное. Механизация труда обусловливает технологические стрессы беременных маток и молодняка. Серьезными стресс-факторами являются неполноценность, несбалансированность рационов, нарушение технологии содержания и кормления, дисбаланс параметров микроклимата животноводческих помещений, зоотехнические процедуры (мечение выщипами, бирковани-ем, татуировками, таврением, взвешивание, определение статей и др.), ветеринарные мероприятия — вакцинации, кастрация (хрячков, бычков), взятие крови, скалывание клычков у поросят и т. д.
Организм животных особенно чувствителен к стрессам в первые 3—4 мес жизни, а материнский организм — в последние 2— 3 мес беременности и первые 2—3 мес после родов. Установлена прямая зависимость между уровнем неспецифической резистентности организма матери, с одной стороны, и внутриутробным развитием эмбриона, состоянием здоровья и сохранностью новорожденных с другой. Например, телята, полученные от коров с субклинической патологией, имеют признаки внутриутробной гипотрофии, среди них — недоразвитость органов и систем, высокая заболеваемость и летальность. У их матерей удлинены сроки отделения последа, повышен риск гинекологических заболеваний, отмечается низкое содержание лактоглобулинов в молозиве.
При стрессе в процесс структурно-функциональных изменений вовлекаются в первую очередь эндокринные органы. Возникающее при этом нарушение нейро-гуморального регулирования неизменно ведет к нарушению обмена веществ, кроветворения, иммунной защиты. Иммунокомпетентные органы ввергаются в депрессию, а степень молозивной пассивной иммунизации является недостаточной в связи с низким содержанием иммуноглобулинов в молозиве таких матерей. Таким образом, развиваются иммунодефицитные состояния.
Иммунодефицитом, или иммунной недостаточностью принято считать нарушение нормального иммунологического статуса, обусловленного деффектом одного или нескольких механизмов иммунного ответа. Различают первичный и вторичный иммуноде-фициты.
Под первичным иммунодефицитом принято понимать генетически обусловленную неспособность организма продуцировать какое-либо звено иммунного ответа, имеющую наследственный характер и проявляющуюся сразу после рождения.
Вторичный (приобретенный) иммунодефицит возникает на фоне нарушения передачи потомству колостральных антител, нарушения обмена веществ, воздействия стресс-факторов, действия ионизирующей радиации и множества других этиотропных звеньев. Причинами вторичных иммунодефицитов являются также сами инфекционные факторы: действие бактерий, вирусов, грибов, гельминтов. Так, переболевая вирусной диареей, теленок становится беззащитным перед пастереллами или хлами-диями.
У сельскохозяйственных животных с десмохориальным и эпи-телиохориальным типом плацентации в норме антитела через плаценту в организм плода не проникают. Обнаружение антител в крови новорожденного до первого кормления молозивом будет свидетельствовать о нарушении плацентарного барьера антигеном и синтезе специфических антител организмом плода. На этом основан способ Ставропольского НИВС диагностики внутриутробного инфицирования по комплексному выявлению в сыворотке крови антител, а в первородном кале (меконии) — антигенов возбудителя.
Гуморальный иммунитет у молодняка сельскохозяйственных животных в первые 3—4 мес жизни, и особенно после рождения, функционально неразвит. Неспецифическая резистентность, в отличие от гуморального иммунитета имеет более развитую физиологическую зрелость. Это обусловлено тем, что синтез всех ее компонентов генетически детерминирован. Поэтому состояние неспецифической резистентности в первые недели и месяцы жизни играет основополагающую роль в защите организма молодняка от инфекционных агентов.
Многие исследователи отмечают снижение основных неспецифических звеньев иммунитета молозивно-молочного молодняка при стресс-воздействии: снижение концентрации лизоцима слюны, носовой и бронхиальной слизи, низкие фагоцитарная активность и активность комплемента сыворотки, повышение (более чем в 1,2 раза) естественного ингибирующего фактора макромоле-кулярных антител (Ig М), а также факторов гуморального иммунитета. Организм животных становится незащищенным перед инфектом.
В таких условиях одним из ветеринарных мероприятий по обеспечению сохранности молодняка в промышленных условиях наряду с биохимическими исследованиями крови матерей (на общий белок, резервную щелочность, кальций, фосфор, каротин), выявлением субклинических маститов у сухостойных коров и акушерско-гинекологической диспансеризацией стали исследования иммунного статуса неонатального и постпрофилакторного молодняка.
Иммунный статус устанавливают наиболее простыми для производственного применения химическими методами определения содержания иммуноглобулинов в сыворотке крови животных: реакцией кольцепреципитации с полиэтиленгликолем 6000; реакциями осаждения иммуноглобулинов цинка сульфатом, натрия сульфитом, натрия гидросульфитом. Существуют также более точные, но более трудоемкие и более дорогостоящие методы определения содержания иммуноглобулинов в крови: физические (рефрактометрический); физико-химические (электрофорез в агаровом геле); иммунохимические (реакция радиальной иммунодиффузии по Манчини).
Получает распространение метод определения циркулирующих иммунных комплексов. Общий сывороточный уровень иммунных комплексов является одним из критериев оценки функциональной зрелости гуморального звена иммунной системы крупного рогатого скота в постнатальный период развития, изменяясь от минимальных значений у новорожденных (0—27 усл. ед.) до физиологических показателей взрослых животных к 18-месячному возрасту (51—53 усл. ед.). Повышенное содержание иммунных комплексов в сыворотке крови новорожденных коррелирует с развитием у них ранних постнаталь-ных инфекций.
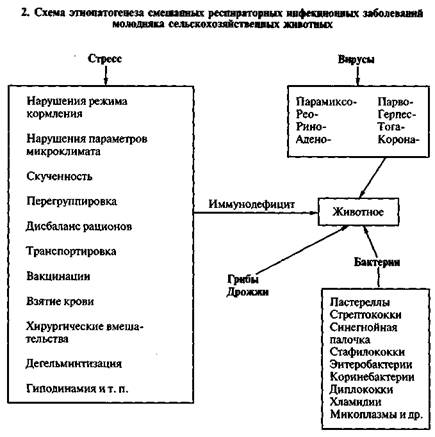
Рассматривая концепцию дальнейшего этиопатогенеза респираторных заболеваний молодняка сельскохозяйственных животных следует отметить пусковую роль вирусов парагриппа-3, инфекционного ринотрахеита, адено-, корона-вирусной, респираторно-синцитиальной, парвовирусной инфекций, реовирусов, возбудителя вирусной диареи и других в смешанных бронхо-легочных инфекционных заболеваниях. Данные многочисленных исследований и эпизоотологического мониторинга подчеркивают высокую циркуляцию перечисленных вирусов в хозяйствах среди крупного рогатого скота, а некоторые исследователи отмечают пантропность таких возбудителей как парамиксовирусы парагриппа, герпесвирусы инфекционного ринотрахеита, коронавирусы. Исследованиями сывороток крови телят в промышленных условиях и смывов из носовой полости выявлены персистенция респираторных вирусов в 70—80% случаев, причем все больше отмечают смешанные циркуляции.
В настоящее время выделяют случаи иммунологической толерантности и персистентной инфекции у телят после рождения, что связывают со способностью многих респираторных вирусов преодолевать плацентарный барьер и инфицировать плод. У таких животных наблюдают постоянную виремию, и они периодически выделяют вирус во внешнюю среду. При этом происходит блокирование иммунореактивности организма вследствие поражения иммунокомпетентных клеток. Последствиями легкого с клинической точки зрения заболевания вирусной диареей — болезнью слизистых являются иммуносупрессия и, как следствие, повышение восприимчивости животных к другим вирусным, бактериальным и грибным инфекциям. Клинически телята, рожденные от инфицированных матерей, могут выглядеть здоровыми, но практически всегда находятся в состоянии лейкопении, угнетении обменных процессов, сдвиге гомеостаза и служат источником возбудителя инфекции.
При постоянном нахождении вирусов на животноводческом комплексе формируется так называемая «стадная устойчивость». В последние годы все меньше отмечается острых вспышек парагриппа, или инфекционного ринотрахеита крупного рогатого скота и т. д. Клинически эти болезни проявляются не часто, в основном в ассоциации с коронавирусами, вирусной диареей и др. Процент серопозитивности при этом бывает высоким, однако значительно колеблется в зависимости от типа хозяйства.
Активизация вирусных возбудителей происходит на фоне им-мунодефицитов (выраженных после стресс-воздействия), а также на фоне снижения местного иммунитета и первичных воспалительных реакций на уровне слизистых трахеи, бронхов и альвеол. Эти воспалительные реакции обусловлены классическими технологическими стрессами при промышленном содержании — нарушении зоогигиенических параметров микроклимата животноводческих помещений, а именно: раздражающее действие (с первичным аллергическим состоянием на уровне респираторного тракта, экссудацией с понижением содержания лизоцима в слизи, отечностью и снижением проницаемости слизистых барьеров) провоцируется повышением концентраций аммиака, сероводорода, углекислого газа выше предельно допустимых (например, при нарушении технологии уборки навоза), повышением скорости движения воздуха при низких температурах в помещении или, наоборот, понижением скорости движения воздуха при температуре помещения выше допустимой. Эти факторы приводят к активизации эпизоотологического процесса респираторных вирусных заболеваний в промышленных условиях на фоне латентных инфекций и скрытого вирусоносительства у переболевших животных.
Следует также отметить, что латентное или персистентное состояние вирусов инфекционного ринотрахеита, вирусной диареи, адено-, парвовирусов и некоторых других также приводит к формированию вторичных иммунодефицитов.
Спазм подслизистой, парез капилляров, экссудация на уровне бронхов и альвеол обусловливают изменение рН альвеолярной среды, снижение биологических защитных механизмов (сурфак-танта, концентрации лизоцима и секреторных иммуноглобулинов и т. д.), что активирует сапрофитную и патогенную микрофлору. Таким образом, дальнейшим этапом смешанных респираторных инфекций являются бактериальные осложнения. Процесс усугубляет повышение микробного загрязнения в животноводческих помещениях выше предельно допустимых концентраций (например, в секционном профилактории для телят — выше 20 тыс. микробных клеток в 1 м3).
При комплексном бактериологическом исследовании хозяйств у больных и павших телят регистрируют как моноинфекцию (пас-тереллез, сальмонеллез, эшерихиоз, анаэробная энтеротоксемия, стрептококкоз, стафилококкоз, псевдомоноз, кандидамикоз), так и смешанные инфекции (пастереллез и эшерихиоз, пастереллез и кандидамикоз, анаэробная энтеротоксемия и стрептококкоз или (и) стафилококкоз, а также другие комбинации). Осложняющими факторами вирусной респираторной инфекции могут быть энте-робактерии (Klebsiella, Е. coli, Salmonella, Citrobacter, Enterobacter, Yersinia), кокковая микрофлора (Streptococcus, Staphylococcus), бактерии семейства Pasteurellaceae (P. multocida, P. haemolytica, Actinobacillus, Haemophilus), синегнойная палочка (Ps. aeruginosa), бордетеллы (В. bronchiseptica), хламидии (Ch. psittaci), микоплаз-мы (Mycoplasma), грибы (Candida и др.), дрожжи и др.
Бактериальные осложнения вирусных респираторных заболеваний приводят к хроническому вялотекущему течению: резкий, сухой, болезненный и частый кашель сменяется более редким, влажным, приступообразным, глубоким кашлем; животные заметно отстают в росте и развитии, вяло реагируют на внешние раздражители; аппетит обычно понижен. Часто такие патологии трудно поддаются лечению, так как осложняющая ассимиляция представлена полирезистентными микроорганизмами к существующим антибиотикам.
Согласно современным представлениям молекулярные механизмы резистентности микробов к антибиотикам обусловливаются следующим: уменьшением адсорбции антибиотиков на поверхности клеточной оболочки бактерии; увеличением продукции ферментов (пенициллиназы и других), которые разрушают отдельные антибактериальные вещества; переносом генетически обусловленной резистентности от одного штамма микроба к другому при помощи плазмид. При неадекватной химиотерапии (сокращение курса, нарушение дозирования, необоснованное и частое применение препаратов из одной группы) часть выживших микроорганизмов дает начало новым поколениям, устойчивым к препаратам исходных групп. Этим объясняется множественная антибиотикоустойчивость сапрофитных бактерий, осложняющих респираторные инфекции.
В итоге смешанное респираторное инфекционное заболевание может закончиться летально вследствие исчерпания компенсаторных резервов организма, резкого угнетения и истощения сил, токсического отравления или развития крупозной пневмонии. При клиническом выздоровлении после смешанного респираторного инфекционного заболевания молодняк еще долго (телята до полугода) не прибавляет в массе и задерживается в развитии. В связи с этим экономические потери при данных патологиях очень высоки и складываются из высокой смертности молодняка, стационарности очага инфекции, задержки роста и развития (низкой оплаты кормов), снижения продуктивности, выбраковки из репродуктивного стада.
Бактериальные инфекции часто являются осложняющим фактором, но могут протекать как сопутствующие или самостоятельные заболевания. При смешанном течении респираторных инфекций изолировать возбудитель вирусной природы обычными вирусологическими методами сложно, и часто их первичная этиологическая роль остается неустановленной вследствие постановки диагноза на бактериальные болезни.
В связи с этим при планировании противоэпизоотических мероприятий необходимо проводить весь комплекс диагностических исследований (как вирусологических, так и серологических, и бактериологических) для расшифровки этиологической структуры конкретной вспышки респираторных заболеваний и выяснения роли каждого инфекционного агента.
В свиноводстве концепция смешанных респираторных инфекционных заболеваний менее изучена. Однако некоторые авторы отмечают роль вирусов гриппа, адено-, корона- и ротавирусных инфекций, микоплазм в качестве пускового механизма патологий на фоне иммунодефицитов. Нередко регистрируют актинобацил-лезную плевропневмонию, гемофилезный полисерозит, бордетел-лез, клебсиеллез, псевдомоноз, лептоспироз как осложняющие инфекции.
При проведении ветеринарных мероприятий необходимо ориентироваться на ведущую инфекцию конкретного случая и применять для лечения больных и подозрительных по заболеванию животных специфические сыворотки.
Эпизоотологический процесс при смешанных инфекциях имеет биолого-экологическую основу. Он представляет эволюцион-но-сложившийся процесс взаимоотношений патогенных вирусов и микроорганизмов с определенными видами животных в определенном биоценозе и зависит от действия природно-географичес-ких, климатических факторов и хозяйственной деятельности человека (схема 2).
В большинстве случаев сложную этиологическую структуру в условиях производства имеют и желудочно-кишечные заболевания молодняка сельскохозяйственных животных. Привычные диагнозы «диспепсия», «гастроэнтерит» по многим данным имеют инфекционную этиологию и вызваны дисбактери-озом и патогенным воздействием кишечных вирусов и бактерий, многие из которых являются сапрофитными и не приносят вреда организму в определенных количествах и при высокой резистентности молодняка.
Эти количества поддерживает нормальная микрофлора кишечника, рН кишечной среды и уровень гомеостаза, ферментная активность пищеварительных желез, иммунный статус организма, функциональное состояние энтероцитов, тип кормления, качество кормов, баланс рационов и другие факторы.
Среди нормальной микрофлоры тонкого кишечника представлены в большей степени лактобактерии (102—104 в 1 г содержимого), энтерококки (10—103), сарцины, бифидобактерии, кишечная палочка, грибы, дрожжи. В нижних отделах кишечника возрастает количество бифидобактерии (107—1010), бактероидов (1010—10"), эшерихий (106—107), представлены энтерококки (106—107), лактобактерии (106—107), клостридии (104—105), вайонеллы (104—105), энтеробактерии других родов, псевдомонады, стрептококки, стафилококки, аэробные бациллы, дифтероиды, грибы (в среднем по 102— 104 в 1г содержимого), единично — фузобактерии, эубакте-рии, копрококки, пептококки и др.
Дисбалансы в биоценозе кишечника здорового организма обусловлены иммунодефицитными состояниями и внешними факторами. Диарея служит примером мультифакторной патологии, в развитии которой участвуют организм теленка, окружающая среда, кормление и инфекционные агенты. Успех в контроле вспышки болезни зависит от своевременного распознавания обусловивших ее факторов и средств коррекции. Идентификация инфекционных агентов является важным обстоятельством, поскольку позволяет правильно определить стратегию контроля болезни. Соответствующие корректировки в кормлении молозивом, молоком, вакцинации, гигиене содержания и кормления, использовании лекарственных средств могут быть применены только в случаях, когда становится ясным, какие инфекционные агенты участвуют в развитии патологического процесса и какова их роль в возникновении болезни.
На фоне выраженных иммунодефицитных состояний, несвоевременного и неадекватного получения молозива новорожденными, антисанитарных условий кормления и содержания, нарушений технологии кормления активизируются инфекционные агенты. Ведущей причиной массовых гастроэнтеритов являются вирусы (рота-, корона-, парво-, энтеро-, торо-, тога-, рео-, калици-, герпес- и астро-), бактерии (эшерихии, сальмонеллы, морганел-лы, цитробактер, листерии, псевдомонады, стрептококки, протей, клостридии, энтеробактер, клебсиеллы), простейшие (криптоспо-ридии, эймерии, балантидии), грибы (фузарии и аспергиллы) и дрожжи.
Некоторые авторы и здесь отводят вирусам роль первичных агентов в большинстве случаев острых заболеваний с синдромом диарея. Микробы, простейшие и грибы отмечают как вторичные причины, осложняющие течение болезни. Однако ученые нередко отмечают развитие дисбактериоза и бактериально-грибной кишечной инфекции без участия вирусного агента (схема 3).
Дата добавления: 2015-11-18; просмотров: 1042;
