ІІІ. Вивчення нового матеріалу. Хімічні властивості водню.
Хімічні властивості водню.
Атоми Гідрогену в молекулах водню сполучені між собою міцним ковалентним неполярним зв’язком. Тому за стандартних умов водень хімічно інертний і взаємодіє лише з найактивнішим неметалом — фтором, з іншими речовинами — при нагріванні, освітленні або наявності каталізатора.
- Взаємодія з неметалами.
2e
 | |||
 | |||
Н20 + Сl20 → 2H+ Cl- Н2 + Si =
 |  | ||

 Н20 – 2е → 2H+ 2 1 – відновник Н2 + Р =
Н20 – 2е → 2H+ 2 1 – відновник Н2 + Р =
2
Сl20 +2 е → 2Cl- 2 1 – окисник
6e

 -3 +
-3 +
 3Н20 + N20 → 2NH3
3Н20 + N20 → 2NH3
4e

 -4 +
-4 +
2Н20 +C0 → CH4
H2 - відновник
Чистий водень горить світло-блакитним полум’ям. (перегляд відеодосліду)
4e

 + -2
+ -2
2Н20+ О20 → 2Н2О
 |
Гримучий газ
Суміш водню з киснем або повітрям здатна вибухати, а чистий водень горить спокійно. Особливо сильно вибухає суміш, яка складається з двох об’ємів водню і одного об’єму кисню, - так званий гримучий газ.
Здатність суміші водню з киснем або повітрям вибухати використовується для перевірки водню на чистоту. Для цього збирають водень у пробірку, тримаючи її догори дном, і підносять отвором до полум’я. Оскільки в пробірці збирається мало водню, то відбувається вибух невеликої сили, цілком безпечний. Якщо водень чистий, вибух супроводжується характерним приглушеним звуком «п-пах», а якщо не чистий – то різким «гавкаючим» звуком. (перегляд відеодосліду або демонстрація)
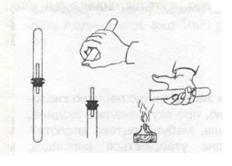
Для хімічних реакцій використовують чистий водень.
- Взаємодіє з лужними і лужноземельними металами утворюючи гідриди.

 2е + -
2е + -
2Na0 + H20 → 2NaH
натрій гідрид


 Na0 – 1е → Na+ 1 2 – відновник
Na0 – 1е → Na+ 1 2 – відновник
H20 + 2е → 2H- 2 1 – окисник
 |
2е +2 -
Сa0 + H20 → СaH2
кальцій гідрид
Н2 – окисник
- Взаємодія з оксидами металічних елементів (як правило, d-елементів)
Водень відновлює метали з їх оксидів (виняток – оксиди лужних і лужноземельних металів)
Демонстрація досліду (або відеодослід)
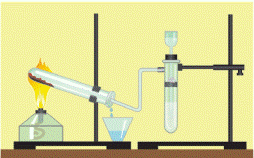
+2 -2 0 t 0 + -2
СuO +H2 → Cu + H2O


 Cu+2 + 2e → Cu0 2 1 – окисник
Cu+2 + 2e → Cu0 2 1 – окисник
H20 – 2e → 2H+ 2 1- відновник

 6e
6e
+6 -2 0 0 + -2
WO3 + 3H2 → W + 3H2O
- Реакції гідрування (гідрогенізації) з органічними речовинами, що мають кратні зв’язки.
(приєднання водню)
Pt
СН2 = СН2 + Н2 → СН3 – СН3
етилен Pt етан
СН ≡ СН + 2Н2 → СН3 – СН3
ацетилен етан
Застосування водню.
Другу колонку таблиці заповнюють учні під керівництвом учителя.
| Галузі використання водню | Властивості водню |
|  3Н2 + N2 → 2NH3
Н2 + Сl2 → 2HCl
СО + 2Н2 → СН3ОН 3Н2 + N2 → 2NH3
Н2 + Сl2 → 2HCl
СО + 2Н2 → СН3ОН
|
| WO3 + 3H2 → W + 3H2O |
| олія + Н2 → маргарин |
| 2Н2+ О2 → 2Н2О + Q Водень горить з виділенням великої кількості теплоти |
| Водень – найлегший газ |
| 6. Д і Т – в атомній енергетиці як термоядерне паливо. | |
| 2Н2+ О2 → 2Н2О (вода, що утворюється під час реакції, не забруднює навколишнє середовище) |
Це цікаво!
У 1889 р. Харківський біохімік К. Данилевський побудував перший в світі керований повітряний аппарат, у якому використовувався балон з воднем.
У 1937 р. Німецький дирижабль «Гінденбург», найбільший у світі на той час, загинув внаслідок вибуху водню. Ця катастрофа поклала край ері водневих дирижаблів.
Дата добавления: 2015-11-10; просмотров: 686;
