Інструкція до виконання досліду
- Складіть прилад, як показано на малюнку.

|

|
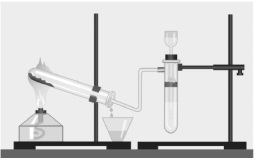
2. Добудьте водень реакцією металу з кислотою й заповніть ним окрему пробірку.
3. Перевірте водень на чистоту.
4. Якщо водень чистий, вставте газовідвідну трубку в пробірку з порошком купрум(ІІ) оксиду якомога ближче до його поверхні. Запаліть сухе пальне й нагрівайте пробірку з оксидом. Спостерігайте за перебігом реакцій. Як тільки порошок почервоніє, нагрівання припиніть.
6. Послідовність дій, спостереження і висновки запишіть у таблиці.Напишіть рівняння реакцій у послідовності їх перебігу, вкажіть тип. Складіть електронний баланс, вкажіть окисник і відновник.
| №п/п | Послідовність дій | Спостереження | Висновок. |
| | В пробірку наливаю хлоридну кислоту і кидаю туди декілька гранул цинку | Спостерігаю утворення бульбашок газу, тобто виділення водню (Н2)
Zn0 + 2Н+ Сl → Zn+2 Cl2 + H20↑
 Zn0-2е → Zn+2 1 – відновник
2Н+ +2е → H20 1 – окисник Zn0-2е → Zn+2 1 – відновник
2Н+ +2е → H20 1 – окисник
| Водень можна добути взаємодією кислоти з активними металами. |
| Водень збираю в пробірку перевернуту догори дном, оскільки водень легший за повітря. Перевіряю водень на чистоту. | Водень згорає зі звуком «п-пах» 2Н2+ О2 → 2Н2О | Чистий водень вибухає з приглушеним звуком «п-пах», а якщо в суміші з киснем – то з різким «свистячим» звуком. |
| | Вставляю газовідвідну трубку у пробірку з чорним порошком купрум (ІІ) оксиду. Вміст пробірки нагріваю. | Спостерігаю почервоніння порошку. Це утворилася мідь.
+2 -2 0 t 0 + -2
СuO +H2 → Cu + H2O
   Cu+2 + 2e → Cu0 2 1 – окисник
H20 – 2e → 2H+ 2 1- відновник Cu+2 + 2e → Cu0 2 1 – окисник
H20 – 2e → 2H+ 2 1- відновник
| Водень – відновник. Він відновлює метали з їх оксидів. |
Зробіть висновки з роботи. Вкажіть фізичні та хімічні властивості водню, які спостерігали під час дослідів. Оцініть практичне значення реакції водню з купрум(ІІ) оксидом.
Домашнє завдання:
Повторити § 18
Урок № 5
Дата добавления: 2015-11-10; просмотров: 1071;
