І. Актуалізація опорних знань.
Перевірка домашнього завдання.
- Впр. 5 ст. 69 – учень працює біля дошки
- Впр. 1-4, 6 ст 69 – усно
- Для допитливих:запропонуйте, який хімічний дослід можна провести, щоб підтвердити вислів «переливання з пустого в порожнє»
 |
.
Експрес – тести (самостійна робота).
- Хімічну формулу водню:
а) Н; б) Н2; в) Н2О; г) Н+.
- Вкажіть прізвище вченого, який відкрив водень:
а) А. Авогадро;
б) Т. Парацельс;
в) Л. Шеєле;
г) Дж. Прістлі.
- З переліку фізичних властивостей виберіть ті, що характерні для водню:
а) найлегший серед газів;
б) має різкий задушливий запах;
в) легко зріджується;
Г) погано розчиняється у воді.
- Добування водню в лабораторії здійснюють за допомогою:
а) колби Вюрца;
б) евдіометра;
в) бюретки;
Г) апарату Кіппа.
5. Водень можна добути:
а) розкладом води;
б) розкладом вуглекислого газу;
в) взаємодією кислот з металами;
г) відновленням еталів з оксидів.
6. Для добування водню в лабораторії можна використати:
а) купрум(ІІ)оксид і хлоридну кислоту;
б) калій перманганат і хлоридну кислоту;
в) цинк і сульфатну кислоту;
г) сірководень і цинк оксид.
7. Вкажіть тип зв’язку в молекулі водню:
а) ковалентний полярний;
б) ковалентний неполярний;
в) йонний;
8. Хімічне рівняння 2НСl + Zn → ZnCl2 + … буде правильним, якщо крапки замінити на:
а) Н2;
б) Н;
в) О2;
г) Сl2.
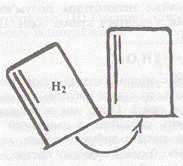
9. Водень можна зібрати:
а) витісненням повітря, оскільки він важчий за повітря;
б) витісненням повітря, оскільки він легший за повітря;
в) витісненням води, оскільки він добре розчинний у воді;
г) витісненням води, оскільки він мало розчинний у воді.
10. Обчисліть, скільки атомів Гідрогену міститься у водні кількістю речовини 0,75 моль:
а) 9,03 ∙ 1023;
б) 1,402∙ 1023;
в) 6,02∙ 1023;
г) 3,01∙ 1023.
ІІ. Мотивація навчальної діяльності.
Ми вже ознайомилися з будовою молекули водню, його фізичними властивостями. Розглянули способи добування і збирання водню. Тож на сьогоднішньому уроці розглянемо хімічні властивості водню та галузі його застосування.
План уроку:
- Хімічні властивості водню:
1.1 Взаємодія з неметалами;
1.2 Взаємодія з металами;
1.3 Взаємодія з оксидами металів;
1.4 Взаємодія з ненасиченими вуглеводнями.
- Застосування водню
Дата добавления: 2015-11-10; просмотров: 1058;
