ІІ. Вивчення нового матеріалу.
Гідроген. Місце в періодичній системі. Будова атома. Ізотопи. Поширеність Гідрогену в природі.
І. Мотивація навчальної діяльності.
Ми завершили з вами вивчати загальну хімію. Переходимо до наступного розділу «Хімія елементів». Наше завдання розглянути найважливіші неметалічні та металічні, положення їх в періодичній системі, будову атома. З’ясувати які прості та складні речовини вони утворюють, описати їх фізичні та хімічні властивості. Охарактеризувати галузі застосування конкретних речовин.
Розпочнемо вивчати хімію неметалів з першого елемента періодичної системи – Гідрогена.
Мета уроку: розглянути Гідроген, як хімічний елемент-неметал.
План.
1. Місце Гідрогену в ПС.
2. Будову атома, ізотопи Гідрогену.
3. Поширення Гідрогену у природі.
4. Біологічну роль.
ІІ. Вивчення нового матеріалу.
Бесіда
Положення Гідрогену в періодичній системі.
 Де в ПС знаходиться Гідроген? Як можна пояснити той факт, що Гідроген може знаходитися одразу в двох комірках таблиці Менделєєва?
Де в ПС знаходиться Гідроген? Як можна пояснити той факт, що Гідроген може знаходитися одразу в двох комірках таблиці Менделєєва?
Гідроген – єдиний хімічний елемент, який має дві комірки в періодичній системі:
а) в І групі головній підгрупі разом з лужними металами, оскільки може віддавати один електрон і набувати ступінь окиснення +1.
Na0 – 1 е → Na+
Н0 – 1 е → Н+
б) в VІІ групі головній підгрупі, разом з галогенами, оскільки може приєднувати 1 електрон і набувати ступінь окиснення -1
F0 +1e → F-1
Н0 + 1e → Н-1
Будова атома
 Запишіть електронну будову атома Гідрогену.
Запишіть електронну будову атома Гідрогену.
+1Н 1ē
+1Н 1S1
|
Н – неметал, s – елемент,
Валентність Гідрогену - І
Ступень окиснення: +1 (основний)
-1 (в гідридах: NaH, CaH2)
 0 (у простої речовини)
0 (у простої речовини)
Складіть три формули речовин з різними ступенями окиснення атома Гідрогену.
Ізотопи Гідрогену
 Пригадайти, що таке ізотопи.
Пригадайти, що таке ізотопи.
Ізотопи – нукліди одного хімічного елемента, які мають однакове число протонів, але різне число нейтронів.
Гідроген має три ізотопи: Протій, Дейтерій, Тритій.
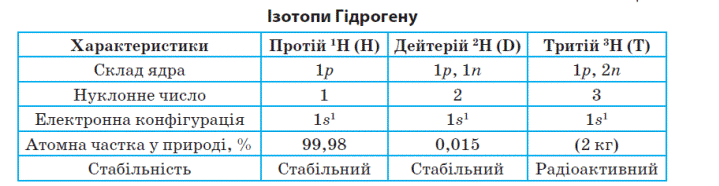 Порівняйте чим відрізняються вони між собою. Для цього розгляньте таблицю підручник с. 65.
Порівняйте чим відрізняються вони між собою. Для цього розгляньте таблицю підручник с. 65.
Протій і Дейтерій – природні ізотопи, Тритій – штучний.
Для кожної сполуки Гідрогену існує дейтерієвий аналог. Наприклад,
Н2О – молекула води, до складу якої входить атоми Протію
D2O - молекула води, до складу якої входять атоми Дейтерію (важка вода)
| Ознака | Н2О | D2O (важка вода) |
| Відносна молекулярна маса | Mr(Н2О) = 18 | Mr(D2О) = 20 |
| Густина | ρ = 1 г/мл | Більша за 1 |
| Температура кипіння | 100°С | 101,4°С |
| Хімічна активність | Дуже активна хімічна речовина | Менша хімічна активність |
Важка вода використовується як сповільнювач нейтронів у ядерних реакторах.
Поширеність у природі
а) Гідроген – основний елемент Космосу (92% усіх атомів)
Сонце складається на 75 % з Гідрогену,
Юпітер — на 80 %,
Сатурн — на 60 %.
б) На Землі Гідроген зустрічається переважно в зв’язаному стані. Входить до складу молекул води, органічних речовин. Вміст Гідрогену у земній корі і гідросфері дорівнює 1 %
У вільному стані, як водень, входить до складу природних газів.
Колообіг Гідрогену
Джерелами надходження Гідрогену в повітряну оболонку Землі є Світовий океан, кратери вулканів, деякі фотохімічні реакції в атмосфері. Через свою легкість водень з атмосфери Землі потрапляє в космічний простір. Але його кількість на Землі не зменшується, тому що ядра Гідрогену

|


|

|

|
|










| |
Біологічна роль Гідрогену
Гідроген входить до складу всих живих організмів. Атоми Гідрогену беруть участь в утворенні водневого зв’язку. Саме водневий зв’язок в живих організмах сприяє:
- утворенню вторинної структури білка;
- забезпечує точне копіювання молекули ДНК;
- розчинення різних речовин у воді.
- Гідроген у складі води бере участь у переміщенні речовин у живому організмі (рух крові, лімфи), у забезпеченні організму киснем.
Дата добавления: 2015-11-10; просмотров: 1425;
