Лекция 4. Предмет химической кинетики. Скорость химической реакции. Влияние различных факторов на скорость химических реакций.
1.Химическая кинетика- раздел физической химии, изучающий скорость и механизм химических процессов, зависимость такой скорости от различных факторов протекания, а также пути протекания реакций. Кинетика изучает влияние на скорость реакции таких факторов, как состояние реагирующих веществ и их концентрация, присутствие посторонних веществ, размер и форма емкости, в которой находятся реагирующие вещества, температура, воздействие различных излучений. Знание кинетики необходимо при разработке химической аппаратуры, для интенсификации и автоматизации промышленных процессов.
Чтобы определить скорость реакции необходимо знать, как изменилась концентрация реагирующих веществ за определенный промежуток времени. Например, в промежуток времени дельтаt концентрация реагирующих веществ уменьшилась с С1 до С2: дельтаС=С1-С2.
2.Скорость химической реакции – изменение концентрации реагирующих веществ в единицу времени (в гомогенных системах):v=дельтаC/дельтаt, где v- скорость реакции (моль/л.сек); дельтаC- изменение концентрации реагирующих веществ (моль/л); дельтаt- единица времени (мин, сек).
Скорость реакции в гетерогенных системах зависит от площади соприкосновения веществ:v=дельтаC/дельтаt*S, где v- скорость реакции ( моль/л.сек.см2); дельтаC- концентрация реагирующих веществ (моль/л); дельтаt- единица времени (сек); .S- площадь соприкосновения реагирующих веществ (см2).
3.Факторы, влияющие на скорость химической реакции: химическая природа реагирующих веществ, температура, концентрация веществ, влияние посторонних веществ, площадь соприкосновения реагирующих веществ.
- химическая природа реагирующих веществ: различные химические вещества обладают разной реакционной способностью. Так, металлы магний и железо реагируют с соляной кислотой с разной скоростью; соляная кислота с большей скоростью реагирует с цинком, чем уксусная кислота.
- концентрация веществ: чем выше концентрация, тем большее число молекул реагирующих веществ находится в единице объема, тем больше вероятность активных столкновений частиц, приводящих к образованию новых молекул, т.е. увеличению скорости реакции.
Учеными Гульдбергом и Вааге, а также русским ученым Н.Н.Бекетовым был сформулирован основной закон кинетики: скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ. Этот закон получил название закона действующих масс.
Для реакции типа аА+вВ = сС+ dD выражение закона будет иметь вид: v=k[A]a[B]b,
где: v - скорость реакции; k - константа скорости; [A], [B] – концентрации реагирующих веществ; а, b - стехиометрические коэффициенты.
Если в реакции участвуют твердые веществ, то учитывается величина поверхности: v=kCS,
где v - скорость реакции; k - константа реакции; C –концентрация реагирующих веществ;
S - площадь поверхности твердых веществ.
Например: в реакции СО+Cl2=COCl2 концентрация оксида углерода равна 0,3 моль/л, хлора – 0,2 моль/л. Как измениться скорость реакции, если увеличить концентрацию хлора до 0,6 моль/л, а оксида углерода до 1,2 моль/л.
Решение:
Т.к. v=k[A]a[B]b, то v1= 0,3х0,2=0,06моль/л, а v2= 0,6х1,2=0,72моль/л.
v2/v1= 0,72/0,06=12.
Скорость реакции увеличится в 12 раз.
- температура: зависимость скорости реакции от температуры определяется правилом Вант – Гоффа, согласно которому при повышении температуры на каждые 100С скорость реакции увеличивается в 2-4 раза:
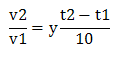
где v1, v2 – скорость реакций при соответствующих температурах, t1, t2- соответствующие температуры; y- температурный коэффициент.
Например: чему равно увеличение скорости реакции при повышении температуры от 10 до 1000С, если температурный коэффициент равен 2.
Решение:
Т.к.
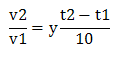
то
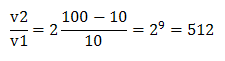
Скорость реакции увеличится в 521 раз.
В химическое взаимодействие вступают только активные молекулы, обладающие энергией, достаточной для осуществления данной реакции. Но молекулы можно сделать активными, если сообщить им необходимую энергию, этот процесс называют активацией. Одним из способов повышения энергии является повышение температуры6 при этом скорость частиц возрастает в геометрической прогрессии, увеличивается скорость реакции. Энергия, которую сообщают частицам, называется энергией активации Еа (кДж/моль, ккал/моль). Чем ниже энергия активации, тем выше энергия системы, а значит, выше скорость химической реакции.
Промежуточный комплекс ( активный комплекс) – переходное состояние превращения исходных веществ в продукты реакции, на которое затрачивается энергия активации:
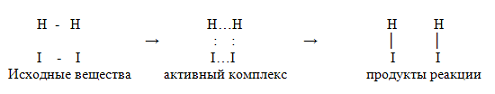
Зависимость скорости от температуры имеет большое значение не только в химической технологии, но и в биохимических процессах, протекающих в живых организмах и пищевых продуктах, которые имеют температурные границы, что обусловлено природой веществ, участвующих в реакции.
- катализ: реакции, идущие с применением катализаторов - веществ, изменяющих скорость химических реакций, но состав и количество которых остаются неизменными, такие реакции носят название каталитических.
Если в процесс А+В=АВ ввести катализатор К, то происходит взаимодействие катализатора с одним из реагирующих веществ А+К=АК , а затем взаимодействие с другим веществом
АК+В= АВ+К.
Катализаторы оказывают разное влияние на скорость химических реакций: одни ускоряют – положительные катализаторы, другие замедляют – отрицательные катализаторы. Катализаторы обладают строгой специфичностью действий, к таким относят ферменты- белковые вещества, которые способны управлять строго определенными процессами. Их применяют в хлебопечении, спиртовой и пивоваренной промышленности, в виноделии.
Вопросы и задания для самоподготовки:
1. Понятие химической кинетики, скорости химической реакции.
2. Факторы, влияющие на скорость химической реакции.
3. Влияние концентрации реагирующих веществ на скорость химической реакции, закон действия масс.
4. Влияние температуры на скорость химической реакции. Правило Вант- Гоффа.
5. Катализ. Положительные и отрицательные катализаторы. Влияние катализаторов на скорость химической реакции.
6. Биокатализаторы, их роль в пищевой промышленности.
Дата добавления: 2015-11-10; просмотров: 3033;
