Лекция 3. Жидкое состояние вещества. Поверхностное натяжение. Вязкость. Твердое состояние вещества.
1.Жидкости- промежуточное состояние веществ между газами и твёрдыми веществами. Подобно газам они текучи и однородны по свойствам, т.е. изотропны. Движение молекул беспорядочно, как в газах, но величина пути движения молекул мала из-за повышения межмолекулярного притяжения. Жидкости отличаются постоянством объёма, не имеют постоянной формы, а приобретают форму сосуда.
Жидкости обладают упругостью; свойства жидкостей зависят от степени диссоциации, природы веществ.
Поверхностное натяжение- сила, действующая на единицу длины линии, ограничивающую поверхность жидкости и направленную в сторону сокращения поверхности. Это связано с тем, что поверхностные молекулы жидкости находятся под действием силы, стремящейся втянуть их вовнутрь. Это приводит к тому, что поверхность жидкости стремится сократиться.
б = A\S ,
где б- поверхностное натяжение;
A – работа, создаваемая поверхностью;
S – площадь поверхности жидкости.
2.Поверхностное натяжение для чистых жидкостей зависит от природы жидкости и температуры, а для растворов- от природы растворителя, природы и концентрации растворенного вещества.
Поверхностное натяжение жидкостей может изменяться при растворении в них различных веществ, которые могут повышать или понижать поверхностное натяжение.
Вещества, снижающие поверхностное натяжение данной жидкости, называют поверхностно- активными веществами.
По отношению к воде ПАВ являются спирты, мыла, белки и другие.
Вещества, повышающие поверхностное натяжение жидкости, называются поверхностно- неактивными веществами. По отношению к воде это минеральные кислоты, щелочи, некоторые соли.
Прибор, которым измеряют поверхностное натяжение- сталагмометр.
p = Vpg\n
p-вес капли жидкости;
V- объём жидкости;
p –плотность жидкости;
g –ускорение свободного падения;
n- число капель жидкости.
Нахождение поверхностного натяжения жидкости относительно другой жидкости.
б =б1p n1\p1n
свойства жидкости от объёма молекулы, формы и их полярности.
Ассоциация- объединение молекул веществ в сложный комплекс. Такие жидкости имеют высокую температуру кипения.
3.Вязкость (внутреннее трение)- сопротивление, возникающие при движении одних слоёв жидкости относительно других.
Величина сопротивления каждой жидкости различна и зависит от химической природы жидкости,т.е. от сил межмолекулярного взаимодействия.
F= nS дельтаv\l
F- сила трения( вязкость);
n –коэффициент пропорциональности;
S- площадь соприкосновения слоёв жидкостей;
дельтаv- разность скорости между слоями жидкости;
l- расстояние между слоями.
Относительная вязкость- отношение вязкости жидкости к вязкости воды (вязкость воды 1 сП (сантипуаз))
n(жид) =n(Н2О)p (жид)t(жид)\ p (Н2О)t(Н2О)
где n –вязкость; p – плотность; t- время вытекания жидкости из сосуда или его части.
4.Твердые вещества сохраняют свою форму в отличие от газообразных и жидких веществ. Частицы твердых тел прочно связаны друг с другом силами сцепления, поступательное движение у них отсутствует и возможно лишь колебательные движения частиц.
Существует 2 вида строения твердых тел:
1. кристаллическое (четкая внутренняя структура, обусловленная правильным расположением частиц в строго определенном, периодически повторяющемся порядке. Размеры кристаллов различны и имеют строго определенную температуру плавления. Дл кристаллов характерна анизотропия (свойства тел в различных направлениях неодинаково, это связано с различием свойств теплопроводности, механической прочности, скорости роста кристаллов, растворения).
Аморфные не имеют определенных температур плавления, размягчаются в определенном интервале температур, при охлаждении становятся твердыми, не имея кристаллической структуры. Характерно постоянство свойств (изотропность). Поликристаллические тела, состоящие и большого числа беспорядочно соединенных мелких кристаллов.
Типы кристаллических решеток
Свойства твердых кристаллических веществ определяется особенностями их кристаллов. Внешняя форма кристалла отражает его внутреннее строение.
Атомы, молекулы или ионы, располагаясь определенным образом в пространстве, образуют пространственную кристаллическую решетку.
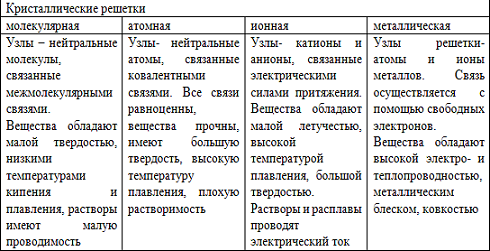
Прочная связь между частицами образующихся кристаллов характеризуются энергией, которую нужно приложить для разрушения кристаллической решетки и удаления частиц на такое расстояние, при котором не происходит взаимодействия между ними ( энергия кристаллической решетки- кДж/моль)
Кристаллы решетки разрушаются при плавлении, испарении и растворении твердых веществ. Все эти процессы протекают с затратой температуры, которая зависит от энергии кристаллической решетки.
При плавлении твердое вещество переходит в жидкое при определенной температуре- температура плавления.
Возгонка (сублимация)- испарение твердого тела, при котором вещество переходит из твердого в газообразное состояние, минуя жидкую фазу.
Кристаллы образуются при остывании расплавов солей, металлов, при выпаривании насыщенных растворов, при резком замерзании пара (снег).
Для начала кристаллизации в растворе или расплавке необходимо наличие центра кристаллизации, вокруг которого идет рост кристаллов из растворов, расплавов и газов.
Вопросы и задания для самоподготовки:
1. Жидкое состояние вещества, свойства жидкости.
2. Сущность поверхностного натяжения.
3. Что такое вязкость? Способы определения вязкости жидкостей.
4. Твердое состояние веществ, виды внутреннего строения твердых тел.
5. Что такое кристаллическая решетка, узел кристаллической решетки?
6. Виды кристаллических решеток, особенности строения веществ с определенной кристаллической решеткой.
Дата добавления: 2015-11-10; просмотров: 9011;
