Теории образования растворов
В создании современной физико-химической теории растворов большую роль сыграли работы рус-ских ученых Д.И. Менделеева, И.А. Каблукова, Д.П. Коновалова и др. В конце 19 в. все растворы считались физическими смесями веществ, в которых отсутствуют взаи-модействия между растворенным веществом и растворителем. Химические явления при растворении были отмечены Д.И. Менделеевым. Взаимодействие молекул растворителя с растворенным веществом называется сольватацией, а образующиеся соединения – сольватами. Если растворителем является вода, то процесс называется гидратацией, а образующиеся соединения – гидратами. Образованием гидратов можно объяснить выделение теплоты при растворении. Образованием гидратов можно объяснить скачкообразное изменение свойств растворов при непрерывном изменении содержания растворенного вещества, что соответствует изменению состава продукта взаимодействия растворителя с растворенным веществом при увеличении содержания вещества в растворе. Явления, наблюдаемые при образовании растворов: увеличении е или уменьшение объема раствора, выделение или поглощение теплоты при растворении веществ, изменение окраски растворов, выпа-дение осадков. В 1887 году С. Аррениус сформулировал основные положения теории электролитической диссоциации, объясняющей поведение солей, кислот, оснований в водных растворах. Теория электролитической диссоциации В растворе электролита имеет место электролитическая диссоциация с образованием ионов. Эта идея была выдвинута С.Аррениусом. Диссоциация – самопроизвольный распад электролита на ионы. Положительно заряженные ионы называются катионами, отрицательно заряженные – анионами. Однако теория Аррениуса не учитывала всей сложности явлений в растворах. Она рассматривала ионы как независимые от растворителя частицы. Но ей противостояла гидратная теория Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. Кажущееся противоречие обеих теорий было устранено предположением о гидратации ионов (И.А. Каблуков). Развитие этой идеи привело к объединению теорий Аррениуса и Менделеева. Распадаться на ионы могут только те молекулы, в которых химическая связь имеет достаточно высо-кую степень ионности. Чтобы ионы молекулы электролита меньше притягивались друг к другу, рас-творитель должен обладать высоким значением относительной диэлектрической проницаемо-сти (ε). Распаду электролита способствуют растворители с высоким значением ε. К ним относится вода (ε = 80,1), уксусная кислота (ε = 57), этиловый спирт (ε = 25). Вещества могут распадаться на ионы и при расплавлении, когда энергии теплового движения оказывается достаточно для разрыва полярных связей. Таким образом, электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении. В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая. В одном - диссоциация протекает при раство-рении веществ с ионной структурой, в другом - при растворении веществ с полярной связью. Когда кристалл соли с ионной связью попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (это ион дипольное взаимодействие). Ионы вещества и молекулы воды притягиваются друг к другу противоположными полюсами. Ионы испытывают тепловые колебания и толчки со стороны молекул воды и этого достаточно, чтобы ионы перешли из кристалла в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом происходит растворение кристаллических веществ с ионной связью. Полярные молекулы растворяющихся веществ притягивают к себе полярные молекулы воды за счет диполь – дипольного взаимодействия, вызывая расхождение полюсов молекулы вещества. Происхо-дит поляризация молекулы, которая совместно с колебательным движением атомов и тепловым дви-жением молекул воды приводит к распаду полярной молекулы на ионы. Образующиеся в обоих слу-чаях ионы гидратируются. При этом ион водорода Н+ (протон) прочно связывается с молекулой во-ды в ион гидроксонияН3О+. Схематически это можно представить уравнением:

В результате этого процесса общая пара электронов молекулы НCl остается у атома хлора, который превращается в ион Cl‾, а протон, внедряясь в электронную оболочку кислорода молекулы во-ды, образует ион гидроксония Н3О+. Протон водорода благодаря малым размерам и электростатическому полю высокой напряженности, а также отсутствию у него электронной оболочки, в водных растворах существует только в виде комплексов с молекулами воды Н3О+ окруженных другими молекулами воды. Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В случае другого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов. Степень диссоциации. Сила электролита В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной оценки процесса диссоциации было введено понятие степени электролитической диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации a. По степени диссоциации в растворах все электролиты делятся на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах принадлежит подавляющее большинство солей, щелочей, а также некоторые кислоты. В водных растворах они диссоциируют практически полностью. Истинная степень их диссоциации близка к 1 (100%), хотя экспериментально наблюдаемая (кажущаяся) находится в пределах от 30 % и выше. Электролиты, степень диссоциации которых в растворе меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном, в недиссоциированном состоянии; для них α < 3%. К ним относят воду, ряд кислот, основанияр-, d- и f- элементов. Между этими группами нет четкой границы, одно и тоже вещество в одном растворителе является сильным, а в другом – слабым электролитом. Согласно теории электролитической диссоциации, кислотой является электролит, кото-рый диссоциирует с образованием ионов Н+. Присутствием ионов Н+ можнообьяснить кислый вкус, способность изменять цвет индикаторов, взаимодействовать с основаниями а также с некоторыми металлами с выделением водорода. Сильные кислоты (HCl, HNO3, H2SO4 и др.) диссоциируют практически полностью, у слабых ки-слот диссоциирована лишь часть молекул. О силе кислот можно судить и по константе диссоциации: чем она больше, тем более диссоциирована кислота. Электролит, диссоциирующий с образованием ионов ОН‾, называется основанием. Наличием ио-нов ОН‾ в растворе объясняется своеобразный "мыльный " вкус, способность изменять цвета инди-каторов иначе, чем кислотами, способность взаимодействовать с кислотами с образованием солей. Сильные основания (LiOH, NaOH, KOH и др.) диссоциируют полностью, у слабых основа-ний диссоциирована лишь часть молекул. Существуют электролиты, которые могут диссоциировать как кислоты, и как основания:
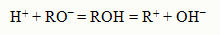
Такие электролиты называются амфотерными электролитами. Амфотерность электролитов объяс-няется малым различием прочности связей R - H и О - Н. Примеромамфотерного электролита может быть гидроксид цинка:
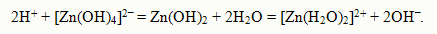
При взаимодействии гидроксида цинка с азотной кислотой образуется нитрат цинка:
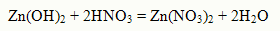
при взаимодействии же с гидроксидом калия – гидроксоцинкат калия:
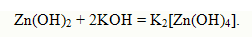
К амфотерным электролитам относятся гидроксиды алюминия Al(OH)3, свинца Pb(OH)2, олова Sn(OH)2. Соли можно определить как электролиты, которые при растворении в воде диссоциируют с образо-ванием положительных ионов отличных от ионов водорода и отрицательных ионов, отличных от гидроксид-ионов. Соли тем лучше диссоциируют, чем меньше заряды ионов, образующих соль.
Дата добавления: 2015-11-10; просмотров: 1982;
