ГЛАВА 16
млекопитающих, или произойти повышение температуры, которое также скажется на их жизнеспособности. Таким образом, как всегда, нужно соблюдать баланс между необходимостью тщательно перемешивать среду и стремлением сохранить целостность клеток.
Есть еще один аспект, касающийся крупномасштабной ферментации, который не имеет отношения к технической стороне процесса, а касается того, используются ли при этом реком-бинантные микроорганизмы. В большинстве стран крупномасштабное культивирование ре-комбинантных микроорганизмов сопряжено с необходимостью соблюдения определенных правил и инструкций. Хотя большинство рекомби-нантных микроорганизмов не представляют никакой опасности, важно не допустить их случайного попадания в среду. Для этого используются надежные системы, предотвращающие утечку живых рекомбинантных организмов или ограничивающие их распространение, если утечка все же произошла. Кроме того, перед окончательным удалением из установки все рекомби-нантные микроорганизмы должны быть инактивированы в соответствии с определенными инструкциями. Использованную культураль-ную среду тоже необходимо проверять на наличие в ней жизнеспособных микроорганизмов, чтобы исключить их попадание в окружающую среду.
Культуры с высокой плотностью
Вообще говоря, при получении чужеродных белков с помощью рекомбинантных E. coti руководствуются тем, что при максимальной конечной плотности культуры получается и максимальное количество продукта. В ферментерах периодического действия с добавлением субстрата концентрация рекомбинантных клеток E. coli достигает 50 грамм сухого вещества на 1 л среды (а в некоторых случаях >100 г/л), (Вес сухого вещества клеток Е. coli составляет примерно 20—25% веса влажного вещества.)
Один из способов повышения плотности культуры состоит в оптимизации культуральной среды. Следует иметь в виду, что некоторые питательные вещества, в том числе источники углерода и азота, при слишком больших концентрациях замедляют рост клеток. Глюкоза подавляет рост при концентрации >50 г/л, аммиак — при концентрации >3 г/л, железо -->1,15 г/л, магний -- >8,7 г/л, фосфор — >10 г/л, цинк — >0,038 г/л. Таким образом, простое увеличение содержания питательных веществ в культуральной среде при периодической ферментации не даст желаемого результата. Кроме того, поскольку состав сложных сред типа пептона или дрожжевого экстракта может немного различаться от раза к разу, ферментация в них не всегда бывает воспроизводимой.
Ацетат, который может подавлять рост клеток, продуцируется Е. coli при росте в условиях недостатка кислорода, но избытка глюкозы. Проблему его образования можно решить, если использовать в качестве источника углерода глицерин вместо глюкозы, понизить температуру или использовать рекомбинантный штамм E. coli, способный превращать ацетат в менее токсичные вещества (см. гл. 6).
В культурах с высокой плотностью может также возникнуть недостаток кислорода. Чтобы избежать этого, увеличивают количество поступающего воздуха (разбрызгивание) либо скорость перемешивания или делают и то, и другое. Кроме того, можно подавать в культуру чистый кислород, а не воздух, в котором содержится только 20% кислорода, или выращивать клетки под давлением, чтобы увеличить растворимость кислорода, В качестве альтернативы предлагалось экспрессировать в хозяйских клетках E. coti ген гемоглобина Vitreoscilla, что значительно увеличило бы поглощение кислорода растущими клетками.
Высокой плотности чаше всего удается достичь при росте в периодическом режиме с добавлением субстрата. Режим подачи питательных веществ может быть разным: непрерывным, ступенчатым или экспоненциальным. При непрерывном режиме в среду в течение всей ферментации вносят одинаковые количества питательных веществ. Однако в этих условиях удельная скорость роста непрерывно снижается. При ступенчатом режиме питательные вещества добавляют по мере увеличения концентрации клеток во все большем количестве, так что снижение удельной скорости роста в значительной мере компенсируется. При экспоненциальном режиме питательные вещества добавляют в количестве, обеспечивающем постоянную скорость роста клеток. Периодическую подачу питательных веществ можно автоматизи-
Промышленный синтез белков при участии рекомбинантных микроорганизмов 357
ровать, основываясь на результатах измерения концентрации лимитирующего субстрата (например, глюкозы) в среде в ходе ферментации.
Биореакторы
При беглом просмотре литературы по биотехнологии создается впечатление, что число типов биореакторов безгранично. Однако на самом деле все биореакторы можно подразделить на три основных группы:
• реакторы с механическим перемешиванием (рис. 16А, А)
• барботажные колонны, через которые для перемешивания содержимого пропускается воздух или другой газ (рис. 16.4, Б)
• эрлифтные реакторы с внутренней (рис. 16.4, В) или внешней (рис. 16.4, Г) рециркуляцией; перемешивание и циркуляция культуральной среды в них обеспечивается потоком газа (обычно воздуха), за счет которого между верхним и нижним слоями культуральной среды возникает градиент плотности.
Чаще всего используются биореакторы первого типа. Они обладают следующими преимуществами:
• позволяют легко менять технологические условия
• всегда есть в продаже
• обеспечивают эффективную доставку газа к растущим клеткам (если говорить на инже-
| Рис. 16.4. Разные типы биореакторов (упрощенная схема), А. Реактор с механическим перемешиванием . Б. Барботажная колонна. В. Эрлифтный реактор с внутренней рециркуляцией. Г. Эрлифтный реактор с внешней системой рециркуляции. Стрелки -- направление потока культуральной среды. | 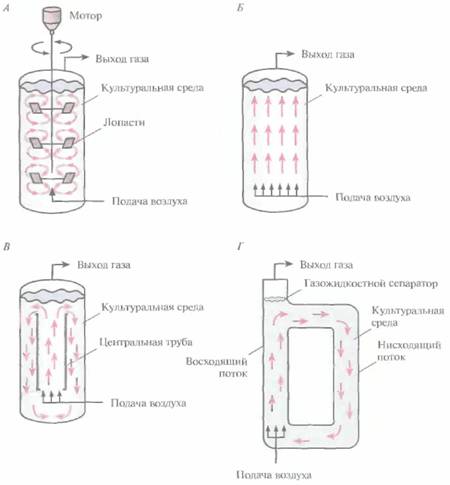
|
358 ГЛАВА 16
нерном языке, обладают высоким объемным коэффициентом массообмена, kLa) • уже давно используются для выращивания различных микроорганизмов.
В реакторах с механическим перемешиванием газ (как правило, воздух) подают в культуральную среду под давлением через разбрызгиватель - - кольцо с множеством маленьких отверстий либо трубку с одним отверстием. В первом случае образуются мелкие пузырьки воздуха и обеспечивается их более равномерное распределение, однако разбрызгиватели в виде трубок используются чаще, поскольку они реже закупориваются. Для равномерного распределения газа по всему объему биореактора используются мешалки — одна или несколько. Они разбивают крупные пузырьки воздуха, разносят их по всему реактору и увеличивают время пребывания в культуральной среде. При сильном перемешивании средний размер пузырьков в больших биореакторах практически не зависит от размера отверстий в разбрызгивателе. Эффективность распределения газа зависит прежде всего от типа мешалки, числа оборотов и физико-химических свойств среды. Если размер биореактора слишком велик, а газ, поступающий из разбрызгивателя, распределяется по объему неравномерно, то даже при энергичном перемешивании гомогенизировать среду не удается.
Многие культуральные среды весьма агрессивны, и во избежание коррозийного или механического повреждения стенок биореактора его обычно изготавливают из нержавеющей стали или стекла. Стеклянные части чаще используют только в лабораторных биореакторах емкостью меньше 50 л.
Размер биореактора лимитируется его способностью эффективно отдавать тепло, выделяемое микроорганизмами в ходе метаболизма и высвобождаемое в результате перемешивания. Если теплоотдача недостаточна, температура среды может превысить критическую, что уменьшит выход продукта. Для отвода тепла используют охлаждающую рубашку или змеевики, помещаемые внутрь реактора. Внутреннее охлаждение более эффективно, однако змеевики часто покрываются слоем растущих клеток, что затрудняет охлаждение, а иногда мешает интенсивному перемешиванию культуральной среды.
Большую опасность представляет загрязнение ферментера грибами или бактериями. Поэтому биореакторы конструируют таким образом, чтобы их можно было стерилизовать; обычно для этого используют пар под давлением. Внутри реактора не должно быть «мертвых зон», недоступных для пара во время стерилизации. Обработке подлежат все клапаны, датчики, входные и выходные отверстия. При конструировании перед инженерами зачастую возникает проблема: использовать максимальное число датчиков для полного контроля за процессом ферментации или ограничиться их минимальным набором, чтобы легче было поддерживать стерильность.
При интенсивном перемешивании культуральной среды в процессе ферментации часто происходит ее вспенивание. Это может привести к переувлажнению фильтра в отверстии, через которое воздух выходит из биореактора, и уменьшению его потока, а также к попаданию в реактор посторонних микроорганизмов. Для контроля пенообразования используют химические пеногасители или механические сбиватели пены. Однако в присутствии химических реагентов может ухудшаться перенос кислорода, а иногда происходить ингибирование клеточных ферментов, что уменьшает скорость роста микроорганизмов. Кроме того, если пеногасители не удалять, они могут загрязнять конечный продукт. Проблему вспенивания можно решить, если оставить в верхней части биореактора достаточно большое пустое пространство, в котором лопались бы пузырьки воздуха. Правда, в этом случае рабочий объем реактора уменьшится примерно на 25%,
Все эти соображения относятся и к «пневматическим» реакторам типа барботажньгх колонн и эрлифтных биореакторов. Таким образом, обеспечение стерильности, постоянства pH и температуры — ключевые требования при любом способе культивирования независимо от конструкции биореактора.
Конструкционные особенности барботажных колонн и эрлифтных биореакторов дают им некоторые преимущества перед реакторами с механическим перемешиванием, «Пневматические» реакторы более экономичны, поскольку
Промышленный синтез белков при участии рекомбинантных микроорганизмов 359
перемешивание в них происходит с помощью восходящего потока воздуха (или другого газа в случае анаэробных микроорганизмов), а не механической мешалки, потребляющей много энергии. Кроме того, в отсутствие механической мешалки исключается и один из путей проникновения в биореактор посторонних микроорганизмов. В пневматических биореакторах в культуральной среде не возникает столь сильных гидродинамических возмущений (сдвига слоев жидкости друг относительно друга), при этом в эрлифтных биореакторах перемешивание происходит более равномерно по всему объему. Уменьшение сдвиговых эффектов очень важно по следующим причинам:
* клетки рекомбинантных микроорганизмов более хрупки, чем нетрансформированные клетки, поскольку часть их энергетических ресурсов расходуется на синтез чужеродных белков и в результате образуется менее прочная клеточная стенка
* самый распространенный ответ клетки на внешнее воздействие — уменьшение количества всех синтезируемых белков, в том числе и рекомбинантных
* под действием сдвиговых эффектов могут изменяться физические и химические свойства клеток, что затруднит дальнейшую работу с ними. Например, может увеличиться количество полисахаридов на поверхности клеток, что приведет к ухудшению условий их выделения и лизиса, а также затруднит очистку рекомбинантного белка.
В барботажных колоннах воздух подается под высоким давлением в нижнюю часть биореактора; по мере подъема маленькие пузырьки воздуха объединяются, что приводит к неравномерному его распределению. Кроме того, подача воздуха под высоким давлением может привести к слишком сильному пенообразованию. Все это ограничивает универсальность данных конструкций и сужает диапазон реализуемых технологических условий, а также уменьшает возможный размер барботажных колонн.
Эрлифтные биореакторы могут использоваться как в экспериментальных установках, так и в целях промышленной ферментации. Газ в
них подается в нижнюю часть вертикального канала. Поднимаясь, он увлекает за собой жидкость к верхней части канала — газожидкостному сепаратору, и здесь частично выходит в воздух. Более плотная деаэрированная жидкость опускается по другому вертикальному каналу ко дну реактора, и процесс повторяется. Таким образом, культуральная среда вместе с клетками непрерывно циркулирует в биореакторе.
Эрлифтные биореакторы бывают двух основных типов. В первом случае реактор представляет собой одну емкость с центральной трубкой, которая обеспечивает циркуляцию жидкости (реакторы с внутренней рециркуляцией) (рис. 16.4, В). Во втором культуральная среда проходит через отдельные, независимые каналы (реактор с внешней рециркуляцией) (рис. 16.4, Г). Конструкция эрлифтных реакторов с внутренней рециркуляцией проще, но если уж реактор построен, его объем и скорость циркуляции остаются неизменными. Напротив, биореактор с внешней рециркуляцией можно модифицировать и создавать разные условия ферментации.
Эрлифтные биореакторы, вообще говоря, более эффективны, чем барботажные колонны, особенно в случае суспензий микроорганизмов с большой плотностью или вязкостью. Перемешивание в них более эффективно и проблема слипания пузырьков не столь велика. В особенно больших эрлифтных ферментерах, таких как ферментер на ] 500 000 л фирмы IC1 (Англия), сконструированный для получения белков одноклеточных микроорганизмов, для прохождения клетками полного цикла в реакторе требуется весьма значительное время. Чтобы обеспечить их субстратами на все время их перемещения с током жидкости, субстраты вводились по всей длине реактора сразу во многих точках.
Типичные крупномасштабные системы ферментации
Рекомбинантные микроорганизмы широко используются для получения разнообразных белковых продуктов, применяющихся в медицине (например, инсулина), а также в качестве своего рода «фабрик» по производству имеющих коммерческую ценность метаболитов (например, антибиотиков). Белки синтезируются наиболее
360 ГЛАВА 16
интенсивно в период от середины экспоненциальной фазы до ее завершения, а метаболиты — в период замедления роста и в стационарной фазе. Все это должно учитываться при выборе параметров крупномасшабных процессов ферментации.
Оптимизация синтеза необходимого продукта — серьезная научная проблема. Если речь идет о белках, то для ее решения обычно используют клонированные гены, находящиеся под контролем сильных регулируемых промоторов. Вначале полагали, что для получения нужного количества продукта будет достаточно конститутивной экспрессии клонированного гена. Однако опыт показал, что при непрерывной транскрипции и трансляции клонированного гена истощаются все энергетические ресурсы клетки и ее рост замедляется. Чтобы приурочить экспрессию клонированного гена к определенной фазе роста, можно использовать механизм индукции. Для этого вначале выращивают клетки в оптимальных условиях до относительно высокой плотности, а затем индуцируют транскрипцию, либо изменяя температуру, либо добавляя в среду тот или иной химический индуктор в зависимости от природы промотора (например, изопропил-ß-тиогалактопиранозид ).
Двухступенчатая ферментация в большом биореакторе (> 100 л) встречается с определенными трудностями, поскольку технически очень сложно быстро повысить температуру (обычно с 30 до 42 °С) в большом объеме или обеспечить быстрое и равномерное распределение химического индуктора. Эту проблему можно решить, если использовать два сообщающихся биореактора (двухступенчатая ферментация): клетки выращивают в одном из них, а индукцию осуществляют в другом. Это позволяет оптимизировать процессы роста и индукции по отдельности и увеличить количество продукта, синтезируемого за единицу времени.
Двухступенчатая ферментация в тандемных эрлифтных биореакторах
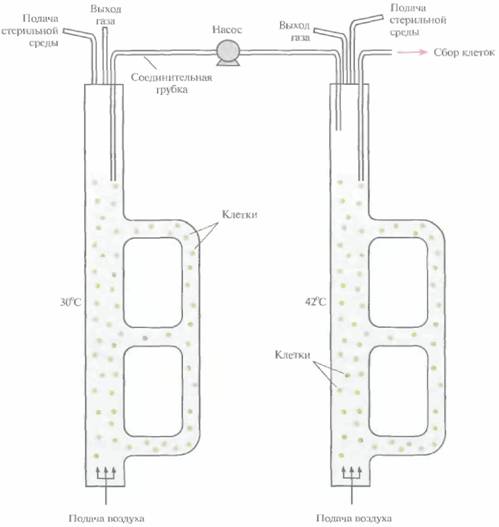
Штамм E. соli NM989, несущий ген ДНК-лигазы Т4 под транскрипционным контролем промотора pL и температурочувствительного репрессора cI, выращивали и индуцировали в двухступенчатом эрлифтном биореакторе (рис. 16.5). Ген
ДНК-лигазы был встроен в хромосомную ДНК, что снимало все проблемы, связанные с нестабильностью плазмид в ходе длительной ферментации. Клетки выращивали при 30 °С в эрлифтном биореакторе с внешней рециркуляцией и рабочим объемом 10 л. В этих условиях ген ДНК-лигазы не экспрессировался. Для индукции при 42 °С использовали эрлифтный биореактор с внешней рециркуляцией и рабочим объемом около 5 л. Биореакторы были соединены трубкой с насосом, который обеспечивал непрерывность подачи суспензии из первого биореактора во второй. Клеточную суспензию, достигшую определенной плотности, удаляли из биореактора, где проходила индукция, и подвергали дальнейшей обработке.
Максимальная удельная скорость роста культуры (µmax) составляла примерно 0,66 ч~1 в первом биореакторе и 0,54 ч~1 во втором, что соответствовало времени удвоения 63 и 77 мин. Свежую среду непрерывно добавляли в ферментер, где росли клетки, со скоростью 2 л/ч, а из ферментера, где происходила индукция, отбирали такой же объем суспензии. Поскольку рабочие объемы биореакторов различались, клетки находились примерно 5 ч в биореакторе, где происходил рост, и 2 ч в биореакторе, где осуществлялась индукция. Различие во времени пребывания клеток в биореакторах было необходимо для оптимизации числа клеток, выхода продукции и стабильности ДНК-лигазы. Само время пребывания клеток в разных реакторах можно варьировать изменением их относительного рабочего объема и объема поступающих в первый биореактор питательных веществ.
Использованный в этой работе эрлифтный ферментер с двойной наружной рециркуляцией (рис. 16.5) позволил упростить регуляцию относительных рабочих объемов ферментеров, а также повысить гибкость системы (обеспечивать разные условия роста для разных популяций рекомбинантных клеток). При синтезе ДНК-лигазы наилучшие результаты были получены при ежеминутном поступлении примерно 33 мл клеточной суспензии из первого биореактора во второй. Это эквивалентно всего 0,67% объема биореактора, где осуществлялась индукция, что обеспечивало практически мгновенный подъем температуры всей поступающей суспензии с 30
Промышленным синтез белков при участии рекомбинантныхмикроорганизмов 361
|
| Рис. 16,5. Система из двух эрлифтных биореакторов, использующаяся для температурной индукции синтеза белкового продукта. Из ферментера, в котором осуществляется культивирование при 30 °С (слева), клетки поступают в ферментер с температурой 42 °С (справа}, где происхоит индукция. У обоих биореакторов имеется двойное внешнее рециркуляционное устройство, оснащенное задвижками. Изменяя положение задвижек, можно создавать рабочий объем, оптимальный для данных условии. |
до 42 °С. Для поддержания роста клеток, находящихся во втором биореакторе, в экспоненциальной фазе в него непрерывно добавлялось нужное количество питательных веществ в концентрированной форме. Это предотвращало расщепление ДНК-лигазы протеолитическими ферментами, которые обычно синтезируются клетками в фазе замедления и в стационарной фазе.
При росте в таком двухступенчатом биореакторе непрерывного действия культура штамма E. coli NM989 может достигать плотности 4 г (сухого вещества) на 1 л, а на долю ДНК-лигазы Т4 может приходиться до 4% суммарного белка в клетке, что соответствует примерно 25 000 ЕД ферментативной активности на 1 г (сухого вещества). Вообще же с помощью описанного подхода можно синтезировать примерно 100 000 ЕД
Дата добавления: 2015-07-14; просмотров: 2470;
