ГЛАВА 16. рируются в нем, а осветленная среда удаляется, Когда барабан заполняется осажденными клетками, центрифугу останавливают и клетки собирают
рируются в нем, а осветленная среда удаляется, Когда барабан заполняется осажденными клетками, центрифугу останавливают и клетки собирают. Основное неудобство данного способа -необходимость останавливать процесс, а затем снова начинать его. Кроме того, недостатками являются высокая стоимость оборудования и потребляемой им энергии, вероятность утечки микроорганизмов в окружающую среду, невозможность полного удаления клеток из среды.
Альтернативный метод выделения клеток из культуральной среды — фильтрация через мембрану. К сожалению, при обычной фильтрации клетки со временем забивают поры мембранного фильтра, накапливаются на его поверхности, и в результате скорость процесса быстро снижается (рис. 16.7, А). Фильтрацию можно ускорить, проводя ее под давлением, но это лишь временный эффект; клетки все равно будут накапливаться на поверхности мембраны, а кроме
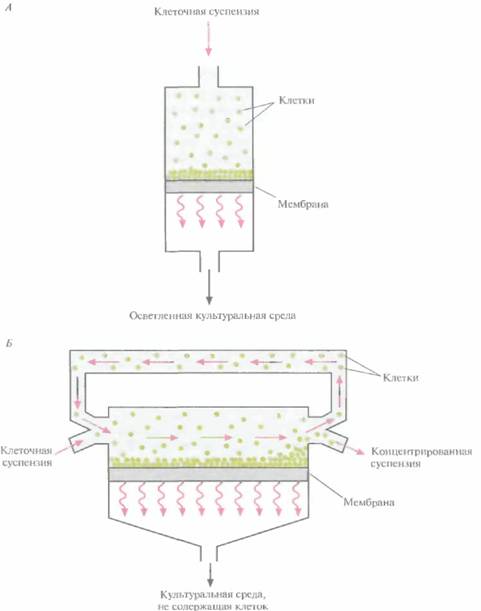
| Рис. 16.7. Способы фильтрации, применяющиеся для сбора клеток. A. Фильтрация с необратимым забиванием фильтра. Б. Фильтрация с параллельным потоком клеточной суспензии. Стрелки — направление потока. |
Промышленный синтез белков при участии рекомбинантныхмикроорганизмов 365
того, под давлением они образуют более плотный и менее проницаемый слой.
Чтобы решить эту проблему, клеточную суспензию пропускают с высокой скоростью параллельно поверхности мембраны (рис. 16.7, Б), так что через мембрану за один раунд проходит только небольшая часть циркулирующей жидкости. Остальная ее часть очищает мембрану от накопившихся клеток (см. рисунок), и в результате скорость фильтрации падает не так быстро, как при необратимом забивании фильтра. После многочисленных раундов фильтрации через мембрану проходит почти вся культуральная среда. Этот метод используется пока только в лаборатории; в промышленных процессах для сбора клеток применяют центрифугирование.
Дальнейшие действия зависят от природы и локализации продукта. Если продукт представляет собой белок, находящийся в культуральной среде, то среду концентрируют, а белок очищают хромотографическими или другими методами. Если продукт — это низкомолекулярное соединение, находящееся в культуральной среде, то используют соответствующие методы экстракции. Наконец, если продукт имеет внутриклеточную локализацию, то прежде чем очищать его, клетки разрушают.
Разрушение клеток
Для разрушения клеток используют разнообразные химические, биологические и физические методы. Все процедуры должны быть достаточно жесткими, чтобы разрушить клеточную стенку, и в тоже время достаточно мягкими, чтобы исключить денатурацию белка. А поскольку клеточные стенки у разных микроорганизмов состоят из разных полимеров, никакого универсального метода их разрушения не существует.
• У грамположительных бактерий клеточная стенка состоит из толстого пептидогликано-вого слоя N-ацетил глюкозам и на и остатков N-ацетилмурамовой кислоты, соединенных пептидными мостиками.
• У грамотрицательных бактерий клеточная стенка тоньше и покрыта снаружи слоем липидов.
• Стенка дрожжевых клеток состоит из плотного слоя частично фосфорилированных маннанов и ß-глюканов.
* Низшие грибы имеют многослойные клеточные стенки, состоящие из α- и ß-глюканов, гликопротеидов и хитина.
Состав и прочность клеточной стенки зависят от условий культивирования, скорости роста клеток, фазы, на которой они собираются, условий хранения сконцентрированных клеток и от того, экспрессировал ли выделенный микроорганизм клонированный ген.
Химические методы разрушения клеточных стенок включают обработку щелочью, органическими растворителями или детергентами. Если белковый продукт не разрушается при pH от 10,5 до 12,5, то можно без труда и дешево лизировать большие количества бактериальных клеток. Например, рекомбинантный гормон роста человека очень просто выделить из клеток Е. сой обработкой гидроксидом натрия при pH 11. После обработки щелочью не остается практически ни одной жизнеспособной клетки, что автоматически решает проблему утечки рекомбинантных микроорганизмов. Обработка органическими растворителями — это простой и недорогой способ разрушения клеток, который используется для выделения ферментов из дрожжей. Однако, чтобы убедиться в том, что в подобранных условиях, белковый продукт не денатурирует, необходимо провести предварительное тестирование. Под действием детергентов в мембранах бактериальных клеток образуются поры, через которые белки и другие молекулы выходят из клетки. К сожалению, детергенты дороги, в большинстве случаев в их присутствии белки денатурируют, а кроме того, они могут загрязнять конечный продукт.
Основным биологическим методом разрушения клеток микроорганизмов является лизис с помощью ферментов. Так, лизоиим яичного белка легко гидролизует клеточные стенки грамположительных бактерий. Для разрушения клеточных стенок грамотрицательных бактерий используют лизоцим и этилендиаминтетрауксусную кислоту (ЭДТА), а клеточные стенки дрожжей гидролизуют с помощью одного или
366 ГЛАВЛ 16
нескольких ферментов: β-1,3-глюканазы, β-1,6-глюканазы, манназы и хитиназы. Ферментативная обработка высокоспецифична, а лизис проходит в мягких условиях. Пока использование ферментов для лизиса клеток сдерживается их высокой стоимостью, но с применением рекомбинантных микроорганизмов для промышленного синтеза ферментов, разрушающих клеточные стенки, эта проблема будет решена.
Клетки можно разрушить и физическими методами: немеханическими (например, с помощью осмотического шока или быстрого многократного замораживания и оттаивания) или механическими (обработкой ультразвуком, с помощью шаровой мельницы, гомогенизации под давлением, соударения). Обычно после обработки немеханическими методами многие клетки остаются неповрежденными. Напротив, механическое разрушение высокоэффективно, что делает его более привлекательным. Особенно часто ультразвуковые излучатели, генерирующие высокочастотные звуковые волны, используют для обработки малых объемов. Клетки разрушаются при этом под действием гидродинамических сил (сдвига слоев жидкости друг относительно друга, кавитации и т. д.).
Для разрушения большого количества клеток обычно используют шаровые мельницы. Концентрированную клеточную суспензию заливают в камеру высокоскоростной шаровой мельницы, заполненную инертным абразивным материалом (например, стеклянными шариками диаметром <1 мм). Содержимое быстро перемешивают с помощью лопастей, насаженных на ось. Большинство клеток разрушается под действием сдвиговых напряжений, возникающих в результате быстрого движения шариков. Условия оптимального разрушения клеток можно подобрать, варьируя число и форму лопастей, скорость перемешивания, размер шариков, их число, концентрацию клеток, геометрию камеры и температуру. Приборы такого типа успешно использовались для разрушения клеток самых разных микроорганизмов. С их помощью можно легко разрушать клетки как нерекомбинантных, так и рекомбинантных микроорганизмов.
При гомогенизации под высоким давлением концентрированную клеточную суспензию продавливают через небольшое отверстие под высоким давлением, а затем давление резко сбрасывают, что и вызывает лизис. Условия обработки можно оптимизировать применительно к разным микроорганизмам. Для этого изменяют рабочее давление, размер и форму отверстия, температуру клеточной суспензии, число продавлива-ний.
Еще один механический метод разрушения клеток -- соударение. Клеточную суспензию большой вязкости направляют под давлением на неподвижную поверхность или навстречу потоку другой суспензии. В месте соприкосновения выделяется большое количество энергии, разрушающей клетки. Таким способом с помощью устройства под названием Microfluidizer за один прием была разрушена большая часть клеток Е. coll в двух встречных потоках суспензии. Однако для разрушения клеток других микроорганизмов может понадобиться большее число раундов. В отличие от гомогенизаторов под высоким давлением и высокоскоростных шаровых мельниц, в которых, как правило, используются концентрированные клеточные суспензии, данное устройство пригодно для обработки любых суспензий. Как показали предварительные исследования, активность клеточных белков уменьшается при разрушении клеток по этой методике лишь незначительно. А если обработать суспензию клеток небольшим количеством лизоцима, а затем использовать устройство Microfluidizer в режиме пониженного по сравнению с обычным давления и при небольшой вязкости, то сохранится активность некоторых лабильных белков, инактивирующихся при высоком давлении.
Дальнейшая обработка
После разрушения клеток их осколки удаляют либо низкоскоростным центрифугированием больших объемов, либо микрофильтрацией через мембрану. Белковый продукт осаждают из грубого или осветленного лизата органическими растворителями (спиртом или ацетоном) или сульфатом аммония. Достигаемое при этом обогащение — 2—5 раз. К сожалению, дороговизна
Промышленный синтез белков при участии рекомбинантных микроорганизмов 367
агентов, использующихся для осаждения, может значительно увеличить стоимость процесса. В качестве альтернативы для концентрирования и выделения суммарных белков можно использовать ультрафильтрацию с параллельным потоком через мембраны с меньшим средним размером пор, чем у мембран, применяющихся для концентрации клеток или удаления их осколков (рис, 16.7, Б). Этот подход пока находится в стадии разработки, однако уже ясно, что он пригоден для работы с объемами от одного до нескольких тысяч литров, процесс может идти непрерывно (что позволяет уменьшить размеры установки) и обеспечивать 10—100-кратное обогащение (в зависимости от размеров и свойств выделяемого белка).
Необходимая степень очистки белкового продукта зависит от того, где его намереваются использовать. В одних случаях это может быть довольно грубый препарат, в других (например, если речь идет о белках, использующихся в медицине) — препарат высокой степени чистоты.
Некоторые белки, синтезирующиеся в клетках в избыточном количестве, образуют нерастворимые частицы (тельца включения). После разрушения клеток их легко можно отделить от большинства других клеточных компонентов. Вначале исследователям не удавалось дезагрегировать выделенные тельца включения так, чтобы при этом не произошла необратимая денатурация белков, но позже были разработаны методы, позволяющие ренатурировать рекомбинантный белок и восстановить его активность. Ясно, что все эти дополнительные процедуры увеличивают стоимость процесса очистки.
Солюбилизация белков
В некоторых случаях при гиперпродукции рекомбинантных белков образуются как растворимые, так и нерастворимые продукты, что усложняет процедуру очистки. Например, при экспрессии в клетках Е. coli гена инсулинопо-добного фактора роста I (IGF-I) человека мол. массой 7,6 кДа примерно 90% рекомбинантных молекул локализуется в периплазме, а 10% секретируется. Чтобы выделить растворимую и нерастворимую формы IGF-I из периплазмы, для солюбилизации нерастворимой формы in situ добавляли мочевину и дитиотрейтол до высоких концентраций при щелочном pH. При этом клетки погибали, но не разрушались, так что цитоплазматические белки оставались внутри клеток. В результате образовывался очень вязкий раствор, что затрудняло осаждение клеток и их осколков центрифугированием. Чтобы решить эту проблему, разработали процедуру двухфазной жидкостной экстракции, позволяющую разделять растворимые и нерастворимые продукты. И солюбилизация in situ, и двухфазная жидкостная экстракция высокоэффективны; с их помощью можно выделить от 80 до 95% IGF-I из культуры объемом от 10 до 1000 л.
ЗАКЛЮЧЕНИЕ
Для крупномасштабного культивирования рекомбинантных микроорганизмов в промышленных биореакторах (>1000 л) недостаточно просто экстраполировать условия роста в лабораторных ферментерах (0,1 — 1,0 л). При конструировании промышленных биореакторов необходимо учитывать такие параметры, как температура, pH, скорость и характер перемешивания, потребность аэробных организмов в кислороде, количество питательных веществ.
Ферментацию можно проводить по-разному. При периодической ферментации посевной материал вводят в свежую культуральную среду и проводят культивирование, не добавляя субстрат до тех пор, пока количество нужного продукта не достигнет максимума. В этих условиях рост культуры проходит шесть этапов; латентную фазу, фазу ускорения, логарифмическую (log) фазу, фазу замедления, стационарную фазу и фазу отмирания. Больше всего белков синтезируется во время логарифмической фазы, а многие низкомолекулярные продукты — во время стационарной. При таком способе ферментации необходимо тщательно следить за тем, чтобы клетки были собраны в нужное время. При периодической ферментации с добавлением субстрата в биореактор добавляют свежую культуральную среду через разные интервалы времени, как правило для того, чтобы продлить логарифмическую фазу. Непрерывная ферментация предполагает добавление свежей среды в течение всего процесса и одновременное удаление клеток и отработанной среды.
368 ГЛАВА 16
Каждая из этих систем ферментации имеет свои недостатки и достоинства, которые нужно учитывать, применяя ее для промышленного синтеза рекомбинантных продуктов. Несмотря на то что непрерывная ферментация применяется в промышленном масштабе не очень широко, этот способ имеет ряд преимуществ и в будущем, по-видимому, получит большее распространение.
Один из подходов к увеличению количества рекомбинантного белкового продукта состоит в максимальном увеличении плотности культуры трансформированных клеток, синтезирующих данный продукт. Для достижения этой цели лучше всего использовать режим периодической ферментации с добавлением субстрата,
Все биореакторы можно отнести к одному из трех основных типов: реакторы с механическим перемешиванием, барботажные колонны, эрлифтные реакторы. В настоящее время в промышленности чаше всего используются биореакторы первого типа, но появляется интерес и к эрлифтным биореакторам. Механическое перемешивание обеспечивается с помощью механической мешалки, а в эрлифтных биореакторах для аэрации и перемешивания используют газ (обычно воздух), который подается под давлением через разбрызгиватель в дне сосуда. При этом во всем объеме происходит непрерывная циркуляция жидкой среды. Барботажные колонны сходны с эрлифтными реакторами, но их недостатком является отсутствие циркуляции культуральной среды. Для обеспечения стерильности, постоянства pH, температуры и других параметров используют разные способы в зависимости от дизайна биореактора. Для синтеза рекомбинантных белков применяют двухступенчатые процессы ферментации, осуществляемые в тандемных эрлифтных биореакторах или в одном реакторе с механическим перемешиванием.
Если синтезированный продукт накапливается в клетках, то их осаждают из культуральной среды центрифугированием или фильтрацией, затем разрушают ферментативными, химическими или механическими методами и выделяют нужный продукт. Если синтезируемый продукт секретируется в культуральную среду, то процедура его выделения и очистки значительно упрощается.
ЛИТЕРАТУРА
Bailey J.E., D.F. Olis.1977. Biochemical Engineering Fundamentais. McGraw-Hill, New York, N.Y.
Charles M.1985. Fermentation scale-up: problems and possibilities. Trends BiolechnoL 3:134-139.
Datar R.1986. Economics of primary separation steps in relation to fermentation and genetic engineering. Process Biochem, 21: 19—29.
Engler C.R.1985. Disruption of microbial cells, p. 305-324. In C.L. Cooney. A.E. Humphrey, M. Moo-Young (ed.), Comprehensive Biotechnology, vol. 2. Pergamon Press, Oxford, United Kingdom.
Giorgio R.J-, J.J. Wu,1986. Design of large scale containment facilities for recombinant DNA fermentations. Trends BiotechnoL 4: 60—65.
Gösset G., R. de Anda, N. Cruz, A. Marttinez, R. Quintero, F. Bolivar.1993. Recombinant protein production in cultures of an Escherichia coli trp strain. Appl. Microbiol. Biotechnol. 39: 541-546.
Grund G., C.W. Robinson, B.R, Click.1991. Croos-flow ultrafiltration of proteins, p. 69—83. In M.D. White, S. Reuveny, A. Shaffetman (ed.), Biologicalsfrom Recombinant Microorganisms and Animal Cells: Production and Recovery. Verlag Chemie, Weinhetm, Germany.
Hart R.A., P.M. Lester, D.H. Reifsnyder, J.R. Ogez, S.E. Builder.1994. Large scale, in situ isolation of periplasmic IGF-f from E. coli. Bio/Technology 12: 113-117.
Kroner K.H.1986. Cross-flow filtration in the downstream processing of enzymes: current status. Biotechnol. Forum 3:20—31.
Kroner, K.H., H. Nissinen, H. Zeigler.1987. Improved dynamic filtration of microbial suspensions. Bio/Technology 5:921-926.
Lee S.V.1996. High cell-density culture of Escherichia coli. Trends Biotechnol, 14:98—105.
McKillip E.R., A.S. Giles, M.H. Levner, P.P. Hung, R.N. Njorth.1991. Bioreactors for large-scale t- PA production. Bio/Technology 9: 805-812.
Mendoza-Vega О., С. Hebert,S.W. Brown.1994. Production of recombinant hirudin by high cell density fed-batch cultivations of a Saccharomyces
Промышленный синтез белков при участии рекомбинантных микроорганизмов 369
cerevisiae strain: physiological considerations during the bioprocess design. J. Biotechnol. 32:249-259.
Merchuk J.C.1990. Why use airlift bioreactors? Trends Biotechnol. 8:66-71.
Park Т.Н., J.-H.Seo, H.C. Lim.1991. Two-stage fermentation with bacteriophage λ as an expression vector in Escherichia coli. Biotechnol. Bioeng. 37:297-302.
Paulson D.J., R.L. Wilson, D.D.Spatz. 1984. Cross-flow membrane technology and its applications. Food Technol. Dec. 1984:77-87.
RamTrez D.M., W.F.Bentley. 1995. Fed-batch feeding and induction policies that improve foreign protein synthesis and stability by avoiding stress response. Bioiechnol. Bioeng. 471 596-608.
Reuss M. 1995. Stirred tank bioreactors, p. 207-255. In J.A. Asenjo, J. Merchuk (ed.), Bioreactor System Design. Marcel Dekker. Inc., New York, N.Y.
Robinson O.K., C.P. Chan, C.Vu Ip, P.K. Tsai, J. Tung, T.C.Seamans, A.B. Lenny, D.K. Lee, J. Irwin,M. Silberklang. 1994. Characterization of a recombinant antibody produced in the course of a high yield fed-batch process. Biotechnot. Bioeng. 44:727-735.
Sauer T., C.W. Robinson, B.R. Click.1989. Disruption of native and recombinant Escherichia coli in a high-pressure homogenizer, Biotechnot. Bioeng. 33: 1330-1342.
SayadiS., M. Nasri, F. Berry,J.N. Barbotin, D.Thomas. 1987. Effect of temperature on the stability of plasmid pTG201 and productivity of xylE gene product in recombinant Escherichia coli: development of a two-stage chemostat with free and immobilized cells. J. Gen. Microbiol. 133: 1901-1908.
Schügerl K., A. Lübbert.1995. Pneumatically agitated bioreactors, p. 257—303. In i.A. Asenjo, J. Merchuk (ed.), Bioreactor System Design. Marcel Dekker, Inc., New York, N.Y.
Schütte H., M.-R. Kula.1990. Pilot- and process-scale techniques for cell disruption. Biotechnol. Appl. Biochem. 12: 599-620.
Seigel R., D.D.Y. Ryu.1985. Kinetic study of instability of recombinant plasmid pPLc23f/pAl in E. coli using two-stage continuous culture system. Biotechnol. Bioeng. 27: 28-33.
Siegel M.H., H. Hallaille, J.C. Merchuk.1988. Airlift reactors: design, operation, and applications. Adv. Biotechnol. Processes!: 79—124.
Strandberg L.,K. Köhler, S.-O. Enfors.1991. Large-scale fermentation and purification of a recombinant protein from Escherichia coli. Process Biochem. 26; 225-234.
Strandberg L., L.Andersson, S.-O. Enfors.1994. The use of fed batch cultivation for achieving high cell densities in the production of a recombinant protein in Escherichia coli. F EM S Microbiol. Rev. 14:53-56.
Strathman H.1985. Membranes and membrane processes in biotechnology. Trends Biotechnol. 3: 112-118.
Tanny G.B., D. Mirelman, T. Pistole.1980. Improved filtration techniques for concentrating and harvesting bacteria. Appl, Environ, Microbiol, 40:269-273.
Tutunjian R.S.1985. Scale-up considerations for membrane processes. Bio/Technology 3: 615-626.
Van Brunt J, 1985, Scale-up: the next hurdle. Bio/Technology 3: 419-424.
Van Brunt J.1986. Fermentation economics. Bio/Technology 4: 395-401.
White M.D., B.R. Click, C.W. Robinson.1995. Bacterial, yeast and fungal cultures: the effect of microorganism type and culture characteristics on bioreactor design and operation, p. 47—87. In J.A. Asenjo, J. Merchuk (ed.), Bioreactor System Design. Marcel Dekker, Inc., New York, N.Y.
Whitney, G.D., B.R. Click, C.W.Robinson. 1989. Induction of T4DNA ligase in a recombinant strain of Escherichia coli. Biotechnol. Bioeng, 33: 991-998.
Yamane T.1995. Bioreactor operation modes, p. 479-509. In J.A. Asenjo and J. Merchuk (ed.), Bioreactor System Design. Marcel Dekker, Inc., New York, N.Y.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. В чем различия между периодической ферментацией, периодической ферментацией с добавлением субстрата и непрерывной ферментацией?
Дата добавления: 2015-07-14; просмотров: 876;
