ГЛАВА 14
|
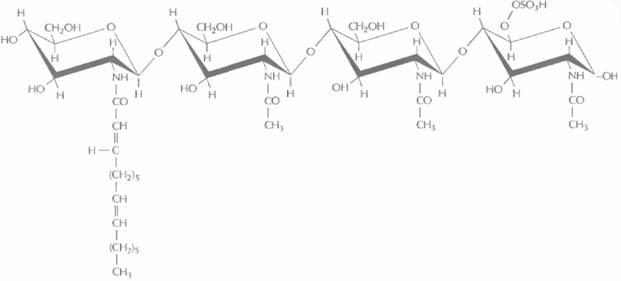
| Рис. 14.7. Предполагаемая структура олигосахаридного фактора NodRm-1. Это соединение обусловливает специфический ответ растения-хозяина, в том числе скручивание и деформацию корня. |
лосков, что считается первым шагом инфицирования корня растения бактерией. Вместе растение и бактерии синтезируют некий олигосахаридный фактор, который модифицируется генным продуктом NodH, a возможно, и продуктами NodQ и NodP. Этот фактор, обозначаемый NodRm-1 (рис. 14.7), обусловливает специфический ответ растения-хозяина, в том числе скручивание и деформацию корня.
В зависимости от штамма Rhizobium или Bradyrhizobium, в конце концов синтезируется примерно 20 дополнительных продуктов nod-генов. Вместе с некоторыми белками, кодируемыми растениями, они участвуют в формировании клубенька.
Чтобы выяснить роль каждого из идентифицированных nod-генов. необходимо провести дополнительные исследования; кроме того, не исключено, что со временем обнаружатся новые nod-гены. Например, секвенирование ДНК и компьютерный анализ показали, что у медленнорастущей формы Bradyrhizobium sp, область ДНК между nodD- и nodABC-генами содержит открытую рамку считывания, а у быстрорастущей формы этой последовательности нет. Открытую рамку считывания обозначили поdК. При инокуляции растений штаммом Bradyrhizobium sp. с мутантным nodK-геном (NodK ) клубеньки на них начинают образовываться на 5 дней раньше, чем у растений, зараженных штаммом дикого типа; при этом число клубеньков удваивается, а урожайность растений увеличивается на 120%.
К настоящему времени не удалось разработать простых генетических подходов, которые позволяли бы использовать nod-гены для повышения конкурентоспособности инокулирую-щих штаммов Rhizobium. Впрочем, можно изменить видоспецифичность бактерий путем переноса nodD-гена из штамма Rhizobium с широкой специфичностью в один из штаммов с узкой специфичностью. Так или иначе, ясно, что образование клубеньков — весьма сложный процесс, и для дальнейшего увеличения конкурентоспособности штаммов Rhizobium потребуются всесторонние исследования с использованием методов генной инженерии.
Биоконтроль патогенных микроорганизмов
Бактерии, стимулирующие рост растений, могут оказывать свое действие прямо или косвенно. Прямая стимуляция обычно состоит в поставке
Бактерии, стимулирующие рост растений 321
растению какого-либо соединения, синтезируемого бактерией (это может быть, например, связанный азот), или растительного гормона. Кроме того, бактерии могут облегчать поглощение растением из окружающей среды некоторых веществ, например железа или фосфора. Косвенная стимуляция заключается в том, что бактерии уменьшают или предотвращают вредное влияние одного или нескольких фитопатогенных организмов — грибов или бактерий. Фитопатогены могут уменьшать урожайность сельскохозяйственных культур на 25—100%, что наносит огромный ушерб. Обычно для борьбы с ними используют химикаты. К сожалению, в большинстве случаев симптомы заболеваний у растений не проявляются достаточно долго, до тех пор, пока изменения в окружающей среде не вызовут пролиферацию бактерий и не приведут к быстрому развитию болезни и к уничтожению всего урожая. Контроль таких обширных эпидемий трудноосушествим и требует больших денежных затрат.
Многие химикаты, использующиеся для борьбы с фитопатогенами, представляют опасность для животных и человека; они накапливаются в природных экосистемах и долго сохраняются в них. Поэтому было бы целесообразно заменить химические способы подавления патогенных микроорганизмов биологическими, более «благоприятными» для среды. Один из биологических подходов к контролю фитопатогенов заключается в создании трансгенных растений, устойчивых к одному или нескольким патогенным микроорганизмам (этот подход обсуждается в гл. 18). Были также предприняты попытки использовать в качестве инструмента биоконтроля бактерии, стимулирующие рост растений. Такие бактерии синтезируют соединения, которые можно использовать для уменьшения ущерба, наносимого растениям фитопатогенами. В их числе —сидерофоры и антибиотики, а также различные ферменты. Впрочем, несмотря на всю перспективность этого подхода, почти все исследования пока проводились в лабораторных условиях, ростовых камерах или в оранжереях. Окончательный же вывод о пользе той или иной стратегии, основанной на использовании какого-то конкретного механизма, можно будет сделать только после полевых испытаний.
Сидерофоры
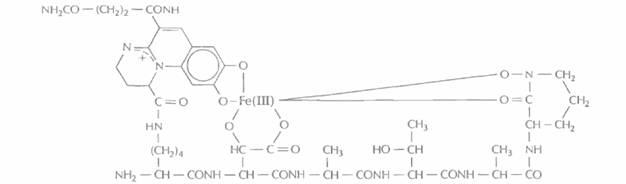
Железо — один из наиболее распространенных на Земле элементов, абсолютно необходимых живым организмам. Однако в той форме, в какой железо присутствует в почве, оно не может прямо использоваться микроорганизмами. Дело в том, что его преобладающей природной формой являются трехвалентные ионы. Их растворимость очень мала— при pH 7,4 она равна примерно 10~18 М, и этого количества абсолютно недостаточно для поддержания роста микроорганизмов. Чтобы выжить в таких условиях, почвенные микроорганизмы синтезируют и секретируют небольшие низкомолекулярные железосвязывающие соединения мол. массой примерно 400—1000 Да, известные под названием сидеро-форов (рис. 14.8). Они эффективно связывают Fe(IlI) и транспортируют его к клеткам микроорганизмов, где оно связывается с клеточными рецепторами и попадает внутрь клеток. Здесь железо высвобождается и может использоваться микроорган измом.
Бактерии, стимулирующие рост растений, подавляют пролиферацию фитопатогенных грибов, синтезируя сидерофоры, которые связывают большую часть Fe(lII), находящегося в слое почвы, непосредственно прилегающем к корню растения (в ризосфере). Фитопатогенные грибы тоже синтезируют сидерофоры, но они обычно обладают более низким сродством к железу, чем сидерофоры, синтезируемые стимулирующими рост растений бактериями. Это позволяет последним одерживать верх в конкурентной борьбе с фито патогенны ми грибами за имеющееся железо.
В отличие от фитопатогенных микроорганизмов, растения, как правило, не страдают от локального истощения железа в почве в результате поглощения его бактериями, стимулирующими рост растений. Большинство растений могут расти при значительно меньших концентрациях железа, чем микроорганизмы. Кроме того, есть данные, что железо, связанное бактериальными сидерофорами, может ассимилироваться растениями и использоваться ими для своих нужд.
Поскольку связывание железа бактериальными сидерофорами может одновременно приводить к подавлению пролиферации самых
322 ГЛАВА 14
|
| Рис. 14.8. Структура сидерофора псевдобактина, продуцируемого штаммом Pseudomonas Β10. С одной молекулой сидерофора связан один ион Fe(III). |
разных фитопатогенных микроорганизмов, исследуется возможность использования их для создания более эффективных систем биоконтроля.
Многие стимулирующие рост растений флуоресцирующие псевдомонады секретируют сидерофор, представляющий собой линейный гексапептид, который состоит из чередующихся L-и D-аминокислот и связанного флуоресцентного хромофора (рис. 14.8). Один из таких сидерофоров, так называемый псевдобактин, обладает сродством к Fe(III) ≅ 1025 л · моль~1. Сходные сидерофоры синтезируют все флуоресцирующие псевдомонады.
Предприняты также первые попытки исследовать синтез псевдобактина у стимулирующей рост растений бактерии Pseudomonas putida WCS358. С помощью мутагенеза были получены 28 мутантов этого микроорганизма, не способных синтезировать сидерофор. Их отбор осуществляли по: 1) отсутствию флуоресценции в УФ-свете; 2) неспособности к росту в присутствии дипиридила — вещества, связывающего большую часть железа в культуральной среде. При очень малых концентрациях ионов железа растут только те клетки, которые синтезируют сидерофоры. Был создан банк клонов ДНК P. putida WCS358 с помощью космидного вектора pLAFRl с широким кругом хозяев и путем конъюгации осуществлена трансформация всех 28 мутантных форм. Трансформанты были проверены на способность к флуоресценции в УФ-свете и/или способность к росту в присутствии дипиридила. Идентифицированы тринадцать
разных комплементирующих космидных клонов со средним размером вставки 26 т. п. н. Детальные исследования показали, что эти клоны соответствуют по крайней мере пяти отдельным кластерам генов.
Один из этих кластеров был исследован более детально. Его минимальная длина составила примерно 33,5 т. п. н., он содержал пять оперо-нов по крайней мере с семью отдельными генами. Таким образом, как и фиксация азота и образование клубеньков, биосинтез сидерофоров -это сложный процесс. Поскольку каждый сидерофор кодируется несколькими генами, получение рекомбинантных бактерий, способных синтезировать модифицированный сидерофор, -задача не из легких. К счастью, есть другие способы повысить эффективность использования бактерий, стимулирующих рост растений, в качестве инструмента биоконтроля. Например, можно расширить круг узнаваемых одним бактериальным штаммом комплексов железо—сидерофор, так чтобы один рекомбинантный штамм мог узнавать и использовать сидерофоры, синтезируемые другими почвенными микроорганизмами, повышая тем самым свою конкурентоспособность. Для этого были клонированы гены рецепторов комплекса железо—сидерофор одной из бактерий, стимулирующих рост растений, и введены в другие штаммы.
Антибиотики
Один из наиболее эффективных механизмов, которые используют стимулирующие рост растений бактерии для подавления пролиферации
Бактерии, стимулирующие рост растений 323
фитопатогенов, — синтез антибиотиков. Так, псевдомонады, использующиеся для биоконтроля, синтезируют такие антибиотики, как агроцин 84, агроцин 434, 2,4-диацетилфлороглюцинол, гербиколин, оомицин, феназины, пиолутеорин и пирролнитрин.
Способность бактерий, стимулирующих рост растений, подавлять пролиферацию фитопатогенов можно повысить, если ввести в эти бактерии гены, кодирующие биосинтез антибиотиков, которые обычно синтезируются другими бактериями. Это позволит расширить спектр фитопатогенов, рост которых способна подавлять одна бактерия. Более того, ограничивая размножение других почвенных микроорганизмов, секретирующие антибиотик бактерии, стимулирующие рост растений, облегчают свою собственную пролиферацию, поскольку уменьшается число конкурентов за ограниченные пищевые ресурсы, а с помощью методов генной инженерии со временем удастся увеличить выход бактериальных антибиотиков.
Синтез большинства противогрибковых метаболитов, продуцируемых псевдомонадами, по-видимому, контролируется белком, который действует как общий регулятор транскрипции; следовательно, уровень синтеза антибиотика можно повысить изменением общей регуляции. Например, в случае Pseudomonas fluorescens СHАО его удалось повысить с помощью трансформации микроорганизма вектором, несущим ген «домашнего хозяйства» rpoD, который кодирует σ70-субъединицу РНК-полимеразы. Рекомбинантный штамм лучше защищал корни растений огурца от повреждений, вызываемых грибом Pythium ultimum (табл. 14.7). В другом исследовании синтез антибиотика пиолутеорина тем же микроорганизмом стимулировали инактивацией генов pqq, участвующих в биосинтезе пирролхинолинхинона — кофактора различных гидрогеназ. Механизм такой стимуляции до конца не установлен; возможно, в результате мутации поток метаболитов от других реакций биосинтеза переключается на биосинтез пиолутеорина.
В настоящее время на рынке имеется только один рекомбинантный микроорганизм, использующийся для биоконтроля: Agrobacterium radiobacter К84, Этот штамм продается в Австра-
| Таблица 14.7. Влияние дополнительных копий rpoD- гена Pseudomonas fluorescens CHA0 на способность этой бактерии защищать корни растений огурца от повреждений, вызываемых патогенным грибом Pythium ultiтит1) | |

| |
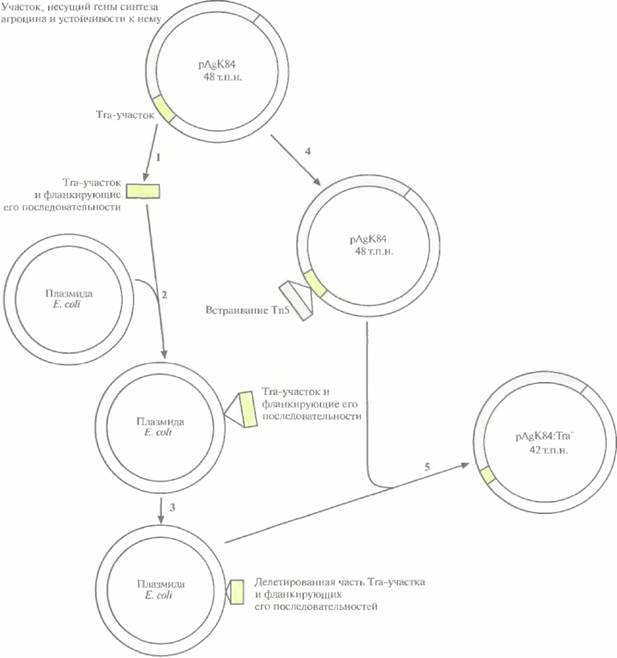
лии начиная с 1989 г. как средство борьбы с корончатым галлом — болезнью, которую вызывает Agrobacterium tumefaciens. Заболеванию подвержены миндаль и косточковые плодовые деревья, такие как персики. A. radiobacter синтезирует антибиотик агроцин 84, токсичный для A. tumefaciens. Однако при случайном попадании в него плазмиды от A. radiobacter, содержащей гены биосинтеза агроцина 84, могут возникнуть агроцинустойчивые штаммы Л. tumefaciens. Чтобы избежать этого, из плазмиды pAgK84, несущей гены биосинтеза агроцина 84, был удален участок, ответственный за перенос плазмиды (рис. 14.9). В результате штамм A. radiobacter больше не мог передавать рекомбинантную агроциновую плазмиду патогенным агробактериям, но сохранял способность к биоконтролю.
Ферменты
Некоторые бактерии, стимулирующие рост растений, синтезируют такие ферменты, как хитиназа, р-1,3-глюканаза, протеаза и липаза, которые разрушают клеточную стенку грибов. В одном из экспериментов удалось снизить частоту возникновения болезней, вызываемых фитопатогенными грибами Rhizoctonia solani, Sclerotium rolfsii и Pythium ultimum, с помощью штамма Pseudomonas cepacia, синтезирующего
|
| Рис. 14.9. Конструирование неспособной к переносу (Тrа~) модификации плазмиды pAgK84 A. radiobacter, кодирующей гены биосинтеза агроцина 84 и гены устойчивости к нему. Используя рестрикционную карту pAgK84, из плазмиды вырезали (1) фрагмент, который содержал участок Тга, ответственный за перенос, вместе с фланкирующими его последовательностями, и встроили его в плазмиду E. coli(2). С помощью рестриктазной обработки из клонированного фрагмента удалили примерно 80% Tra-участка и часть фланкирующих его последовательностей (в сумме примерно 6 т.п.н.) (3). Осуществили гомологичную рекомбинацию между плазмидой E. coli, содержащей «урезанный» Tra-участок, и плазмидой pAgK84, которая содержала встроенный в Tra-участок транспозон Тn5 с геном устойчивости к канамицину (4). Получили несколько производных плазмиды pAgK84 с частично удаленным Тга-участком (5), Тга~-плазмида pAgK84 больше не могла передаваться другой агробактерии в ходе конъюгации, но все еще была способна детерминировать синтез агроцина 84 и обеспечивать устойчивость к нему. Рисунок выполнен без соблюдения масштаба. |
Бактерии, стимулирующие рост растений 325
фермент β-1,3-глюканазу, который разрушал грибной мицелий. В ходе других исследований было показано, что противогрибковая активность трех штаммов Enterobacter agglomerans, стимулирующих рост растений, обусловлена наличием у них комплекса из четырех разных полипептидов, которые, действуя совместно, расщепляют хитин клеточной стенки грибов. Эти бактерии хорошо защищали растения хлопчатника от заражения Rhizoctonia solani. В то же время Тn5-мутанты Е. agglomerans, не продуцирующие активной хитиназы, не были способны защитить растения от патогенных грибов.
Многие бактериальные ферменты, разрушающие клеточную стенку грибов, в том числе хи-тиназа и ß-глюканаза, кодируются одним геном. Было бы разумно выделить эти гены и ввести их бактериям, стимулирующим рост растений, с тем чтобы получить штаммы, синтезирующие, например, и антибиотики, и ферменты, разрушающие клеточную стенку грибов. Были проведены эксперименты, в которых ген хитиназы, выделенный из бактерии Serratia marcescens, был перенесен в клетки Trichoderma harzianum и R. meliloti. Оба трансформированных микроорганизма синтезировали хитиназу и обладали повышенной противогрибковой активностью. При введении гена хитиназы S. marcescens в штамм P. fluorescens. стимулирующий рост растений, был получен трансформант, стабильно секретирующий хитиназу и эффективно подавляющий размножение фитопатогенного гриба Rhizoctonia solani.
Образование кристаллов льда и антифризные белки
Некоторые патогенные поражающие листья бактерии типа Pseudnmonas syringae синтезируют при низких температурах специфические белки, служащие центрами образования кристаллов льда на поверхности листа при температурах ниже нуля. По мере своего роста кристаллы прокалывают растительные клетки и необратимо повреждают растение, а бактерии получают в свое распоряжение питательные вещества, высвободившиеся из разрушенных растительных клеток. Если белки — центры кристаллизации на поверхности листа — отсутствуют, то непродолжительные ночные заморозки могут и не принести вреда растению, поскольку образование кристаллов льда в цитоплазме растительной клетки обычно начинается при температуре на несколько градусов ниже точки замерзания (т. е. происходит ее переохлаждение). Чтобы предотвратить кристаллизацию на листьях таких культур, как земляника, можно еше до заморозков распылить над растениями мутантные бактерии P. syringae, не способные синтезировать белки — центры кристаллизации. Такие мутантные формы могут быть созданы с помощью технологнии рекомбинантных ДНК или обычного мутагенеза с последующим отбором, и они при достаточной концентрации вытеснят бактерии дикого типа.
Одним из важных условий эффективности биоконтроля патогенных микроорганизмов с помощью бактерий, стимулирующих рост растений, является способность этих бактерий к распространению в естественных условиях. В Канаде, скандинавских странах и на севере США они должны сохранять жизнеспособность в условиях долгих холодных зим, а весной размножаться при относительно низких температурах почвы (~5—10 °С). Поскольку микроорганизмы используют разные адаптивные стратегии выживания в неблагоприятных условиях, можно попытаться сконструировать с помощью генной инженерии рекомбинантные бактерии, оптимально приспособленные к низким температурам. Недавно было показано, что некоторые почвенные бактерии (а среди них встречаются и такие, которые стимулируют рост растений) могут размножаться при 5 °С и секретировать в окружающую среду антифризные белки при низких температурах. Такие белки регулируют образование кристаллов льда внутри бактериальной клетки. Хотя в их присутствии кристаллы все же формируются, они не достигают больших размеров и не разрушают клетки. Как только будут идентифицированы гены бактериальных антифризных белков, их можно будет перенести в клетки бактерий, стимулирующих рост растений, с тем чтобы получить трансформированные бактерии, устойчивые к низким температурам. Пока нет никаких данных о наличии связи между антифризной активностью бактерий и механизмом, обеспечивающим их выживание при низких температурах. Очень ин-
326 ГЛАВА 14
тересно проверить, является ли синтез антифризного белка частью адаптивной стратегии, используемой некоторыми бактериями для обеспечения устойчивости к холоду.
Стимуляция роста растений свободноживущими бактериями
Бактерии, стимулирующие рост растений, оказывают свое действие несколькими способами: 1) фиксируют атмосферный азот, который затем используется растением; 2) синтезируют сидерофоры, которые солюбилизируют и связывают железо из почвы и обеспечивают им растительные клетки; 3) синтезируют фитогормоны, ускоряющие разные стадии роста; 4) солюбилизируют минеральные вещества (такие, как фосфор), которые затем используются растением; 5) синтезируют ферменты, способные регулировать уровень растительных гормонов. Каждая бактерия, стимулирующая рост растений, может использовать один или несколько из этих механизмов.
Фиксация азота вносит совсем небольшой вклад в тот положительный эффект, который дают бактерии, стимулирующие рост растений. Не все такие бактерии являются диазотрофами, а многие из них усваивают лишь ограниченное количество азота.
Для поглощения железа из почвы некоторые растения используют бактериальные комплексы железо—сидерофор; без этого их рост в большинстве случаев был бы сильно замедлен. Однако, несмотря на то что бактериальные сидерофоры несомненно вносят вклад в питание растений и, следовательно, в их рост, этот эффект, как правило, не очень велик.
Как именно бактерии, стимулирующие рост растений, способствуют поглощению растением таких минеральных веществ, как фосфор, до конца не установлено. Высказывалось предположение, что у растений, обработанных стимулирующими их рост бактериями, лучше развивается корневая система, а потому они более эффективно поглощают из почвы нужные им вещества, т. е. влияние бактерий носит опосредованный характер. Однако эксперименты с Azospirillum показали, что этот организм увеличивает поглощение именно минеральных веществ, возможно, синтезируя и секретируя органические кислоты, которые растворяют и связывают некоторые из этих веществ.
Очень часто различные эффекты бактерий, стимулирующих рост растений, объясняют способностью их к синтезу фитогормонов. Большинство исследований в этой области относится к выяснению роли одного из классов фитогормонов — ауксинов. Наиболее распространенный и лучше всего охарактеризованный ауксин это индолил-3-уксусная кислота (ИУК). Она стимулирует как быстрые ответы (например, удлинение растительных клеток), так и длительные (ускорение деления и диффе-ренцировки). Растения тоже могут синтезировать ауксин. Часто это не позволяет определить, какой именно ауксин дает необходимый эффект: бактериальный или растительный. Тем не менее можно утверждать, что бактерии, стимулирующие рост растений, оказывают свое действие именно через изменение гормонального баланса в растениях.
Недавно обнаружилось, что многие бактерии, стимулирующие рост растений, синтезируют фермент, способный регулировать уровень растительного гормона этилена. Этот фермент, 1-аминоциклопропан-1-карбоксилат(АЦК)—дезаминаза, гидролизует АЦК, который является непосредственным предшественником этилена при биосинтезе в растениях. Одно из объяснений роли этого фермента состоит в следующем. Бактерия связывается с оболочкой семени или с корнями растения, а затем поглощает и гидролизует АЦК, понижая концентрацию этилена в тканях растения. Во многих растениях этилен стимулирует прорастание семян и выводит их из состояния покоя; однако, если после прорастания уровень этилена оказывается слишком высоким, удлинение корней замедляется. Таким образом, бактериальная АЦК—дезаминаза предотвращает уменьшение-скорости роста корней, и растение развивается быстрее. Кроме того, многие бактерии, стимулирующие рост растений, синтезируют ИУК, а избыток ИУК, не израсходованный на стимуляцию удлинения растительных клеток или ускорение деления, активирует АЦК-синтазу, что приводит к повышению концентрации этилена. Присутствие активной АЦК—дезаминазы препятствует накоп-
Бактерии, стимулирующие рост растений 327
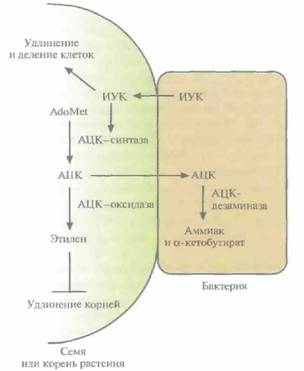
| Рис. 14. 10. Схематическое изображение механизма, с помощью которого бактерии, стимулирующие рост растений, снижают концентрацию этилена в растительных тканях и тем самым предотвращают ингибирование роста корней. Бактериальная клетка, прикрепившаяся к поверхности семени или корня развивающегося растения, синтезирует и секретирует индолил-3-уксусную кислоту (ИУК), стимулирующую рост растения. Попадая в растение, бактериальная ИУК (вместе с ИУК, синтезируемой самим растением) стимулирует либо деление растительной клетки и ее удлинение, либо фермент АЦК-синтазу, который катализирует превращение S-аденозилметионина (AdoMet) в АЦК. Значительная часть АЦК вместе с другими малыми молекулами, обычно содержащимися в семенном или корневом эксудате, экскретируется корнями растения или семенами, поглощается бактерией и гидролизуется АЦК-дезаминазой до аммиака и α-кетобутирата. В результате количество АЦК вне растения снижается. Чтобы сохранить равновесие между АЦК внутри и снаружи, растение секретирует его больше. Соответственно его концентрация, а следовательно, и концентрация этилена в растительных тканях уменьшается. (Из работы Glick et al., J. Theor. Вiol., in press.) |
лению АЦК даже при высоких концентрациях ИУК,так что концентрация этилена не повышается до уровня, при котором замедляется рост растения (рис. 14.10). После детального изучения механизмов, с помощью которых бактерии, стимулирующие рост растении, оказывают свое действие, появится возможность создавать рекомбинатные микроорганизмы, способные стимулировать рост самых разных растений в различных условиях.
ЗАКЛЮЧЕНИЕ
Многие почвенные микроорганизмы обладают способностью стимулировать рост растений. Были исследованы молекулярные механизмы, лежащие в основе этой стимуляции, с тем чтобы выяснить, можно ли использовать полезные почвенные бактерии вместо химических удобрений. Полезные бактерии могут оказывать свое влияние непосредственно, поставляя растениям фиксированный азот, хелатированное железо, фитогормоны или облегчая поглощение ими фосфора. Но влияние может быть и опосредованным, через подавление роста фитопатогенных микроорганизмов.
Из всех бактерий, стимулирующих рост растений и уже использующихся в сельском хозяйстве, наиболее детально изучены члены семейства Rhizobium и Bradyrhizobium. Эти микроорганизмы вступают в сложные облигатные симбиотические отношения со строго определенными растениями.
Молекулярные основы фиксации азота всесторонне исследовались на К. pneumoniae, которая может служить модельной системой для изучения симбиотических бактерий семейств Rhizobium и Bradyrhizobium. Детально охарактеризована нитрогеназа, азотфиксирующий фермент. Молекулярно-генетические исследования показали, что фиксация азота бактериями — это сложный процесс; в нем участвует семь координирование регулируемых оперонов, кодирующих в общей сложности 20 разных белков. Это делает пока невозможным создание с помощью методов генной инженерии растений, которые могли бы сами усваивать азот, и других азотфиксирующих бактерий.
Азотфиксирующий фермент нитрогеназа, используя энергию гидролиза АТР, катализирует образование газообразного водорода (Н2). Некоторые штаммы Rhizobium синтезируют фермент гидрогеназу. Он катализирует превращение in vivo H, в Н+, что увеличивает эффек-
328 ГЛАВА 14
тивность фиксации азота. Если штамм содержит неактивную гидрогеназу, его способность фиксировать азот и стимулировать рост растения уменьшается, С учетом всего сказанного выше были предприняты попытки ввести клонированные гены гидрогеназ в штаммы Rhizobium, вступающие в симбиотические отношения с сельскохозяйственными культурами. По предварительным данным, проводя генноинженерные модификации генов гидрогеназ, можно создать штаммы Rhizobium, обладающие более высокой способностью стимулировать рост растений.
Вступая в симбиотические отношения с растениями, штаммы Rhizobium стимулируют образование на их корнях клубеньков, где и происходит размножение этих бактерий и фиксация азота. Разумно было предположить, что, если с помощью методов генной инженерии удастся создать бактерии, способствующие образованию большего количества клубеньков, конкурентоспособность инокулирующих штаммов Rhizobium в борьбе за место на корнях растений-симбионтов повысится по сравнению со штаммами дикого типа, К сожалению, обнаружилось, что в образовании клубеньков участвует множество разных генов, и эта сложность затрудняет проведение соответствующих молекулярно-генетических экспериментов.
Опосредованная стимуляция роста растений бактериями состоит в защите растений от повреждений, вызываемых фитопатогенными грибами или бактериями. Такая зашита осуществляется при участии специфических соединений, синтезируемых бактериями, которые стимулируют рост растений: сидерофоров, антибиотиков, других малых молекул и различных ферментов. Некоторые другие продукты синтеза, в частности фитогормоны и АЦК—дезаминаза, влияют на рост растений непосредственно. Есть надежда, что когда-нибудь гены биосинтеза всех перечисленных соединений можно будет использовать для создания бактерий — более эффективных стимуляторов роста растений.
ЛИТЕРАТУРА
Adams M. W. W., L. E. Mortenson, J.S. Chen.1981. Hydrogenase. Biochitn, Biophys. Acta 594: 105-176.
Albrecht S. L.f R. J. Maier, F. J. Hanus, S. A. Russell, D. W. Emerich, H. J.Evans. 1979, Hydrogenase in Rhizobium japonicum increases nitrogen fixation by nodulated soybeans. Science 203: 1255-1257.
Arp D. J. 1990. H2 cycling in N2 fixation: past, present, and future outlook, p. 67—76. In P. M. Gresshoff, L E. Roth, G. Stacey, W. E. Newton (ed.), Nitrogen Fixation: Achievements and Objectives. Chapman & Hall, New York, N.Y.
Bar-Ness E.f Y. Chen, Y.Hadar, H.Marschner, V. Römheld.1991. Siderophores of Pseudotnonas puttda as an iron source for dicot and monocot plants, p. 271-281. In Y. Chen, Y. Hadar (ed.), Iron Nutrition ana Interactions in Plants. Kluwer Academic Publishers, Dordrecht, The Netherlands.
Cantrell M. A., R. A. Haugland, H. J. Evans.1983. Construction of a Rhizobium japonicum gene bank and use in isolation of a hydrogen uptake gene. Proc. Natl. Acad. Sei. USA 80: 181-185.
Chet I., J. Inbar.1994, Biological control of fungal pathogens, Appl Biochem. Biotechnol. 48: 37-43.
Crosa J. H.1989. Genetics and molecular biology of siderophore-mediated iron transport in bacteria. Microbioi. Rev. 53: 517-530.
Evans H. J., A. R. Harker, H. Papen, S. A. RusseU, F. J. Hanus, M. Zuber.1987. Physiology, biochemistry, and genetics of the uptake hydroge-nase in Rhizobia. Annu. Rev. Microbioi. 41: 335-361.
Fischer H.-M.1994. Genetic regulation of nitrogen fixation in Rhizobia. Microbioi. Rev. 58: 352-386.
Glick B. R1995. The enhancement of plant growth by free-living bacteria. Can. J. Kficrvbioi. 41:109-117.
Glick B. R., Y.Bashan. 1997. Genetic manipulation of plant growth-promoting bacteria to enhance biocontrol of phytopathogens. Biotechnol. Adv. 15:353-378.
Glick B. R., C. B. Jacobson, M. M. K.Schwar/c, J. J. Pasternak.1994. l-Aminocyclopropane-1-carboxylic acid deaminase mutants of the plant growth-promoting rhizobacterium Pseudomonas putida GR12-2 do not stimulate canola root elongation. Can. J. Microbioi. 40: 911-915.
Glick B. R., D. M.Penrose, J. Li. A model for the lowering of plant ethylene concentrations by
Бактерии, стимулирующие рост растений 329
plant growth-promoting bacteria. / Theor. ВЫ., in press.
Glick B. R.,.). Zeisler, A. M. Banaszuk, .1. D. Friesen, W. G. Martin. 1981. The identification and partial characterization of a plasmid containing the gene for the membrane-associated hydrogenase from E. colt. Gene 15: 201-206.
Gresshoff P. IVL, L. E. Roth, G. Stacey, W. E. Newton (ed.). 1990. Nitrogen Fixation: Achievements and Objectives. Chapman & Hall, New York, N.Y.
Hennecke H.1990. Nitrogen fixation genes involved in the Bradyrhizobium japonicum-soybean symbiosis. FEBS Lett. 268: 422-426.
Higashi S. 1993. (/^йф>)КА/доем/т-р1ап1 communications involved in infection and nodulation. J. Plant Res. 106:201-211.
Jones D. A., M, H. Ryder, B. G. Clare, S. K. Farrand, A, Kerr.1988. Construction of a Tra — deletion mutant of a pAgK84 to safeguard the biological control of crown gall. Mol. Gen. Genet. 212:207-214.
Kloepper J. W., R. Lifshitz, M. N. Schroth.1988. Pseuâomonas inoculants to benefit plant production. 1SI Atlas Sei. Anim. Plant Set. 60-64.
Layva A-, J. M. Palacios, T. Mozo, T.Ruiz-Argüeso.
1987. Cloning and characterization of hydrogen uptake genes from Rhizobium leguminosarum. J. Bacterial. 169: 4929-4934.
Lerouge P., P. Roche, С Faucher, F.Maillet, G. Truchet, J, C.Promé, J. Dénaric.1990. Symbiotic host-specificity of Rhizobium melüoti is determined by a su 1 ρ hated and асу la ted oligosaccharide signal. Nature 344: 781—784.
Long S. R., \V. J. Buikema, F. M.Ausübet. 1982. Cloning of Rhizobium meliloti nodulation genes by direct complementation of Nod~ mutants. Nature 298: 485-488.
Lynch J. M.1990. Beneficial interactions between microorganisms and roots. Biotechnol. Adv. 8: 335-346.
Marugg J. D., M. van Spanje, W. P. M. Hoekstra, B.Schippers, P. J. Weisbeek. 1985. Isolation and analysis of genes involved in siderophore biosynthesis in plant-growth-stimulating Pseudomonas putida WC358. /. BacterioL 164:563-570.
Marugg J. D., H. B. Nielander, A. J. G. Horrevoets, I. van Megen, I, van Genderen, P. J.Weisbeek.
1988. Genetic organization and transcriptional
analysis of a major gene cluster involved in siderophore biosynthesis in Pseudomonas putida WCS358. J. BacterioL 170: 1812-1819.
Morris R. O.1986. Genes specifying auxin and cytokinin biosynthesis in phytopathogens. Anna. Rev. Plant Physiol. 37: 509-538.
Mylona P., K. Pawlowski, T. Bisseling.1995. Symbiotic nitrogen fixation. Plant Cell 7: 869-885.
Nap J.-PM T. Bisseling.1990. Developmental biology of a ptant-prokaryote symbiosis: the legume root nodule. Science 250: 948-954,
Neilands J. В.,S. A.Leong. 1986. Siderophores in relation to plant growth and disease. Annu. Rev. Plant Physiol. 37: 187-208.
O'Sullivan D. J., F. О'Gara.1992. Traits of fluorescent Pseudomonas spp. involved in suppression of plant root pathogens. Microbiol. Rev. 56: 662-676.
Paau A. S. 1991. Improvement of Rhizobium inoculants by mutation, genetic engineering, and formulation. Biotechnol. Adv. 9: 173-184.
Patten C. L., B. R. Click.1996. Bacterial biosynthesis of indole-3-acetic acid. Can. J. Microbiol. 42: 207-220.
Peters J. W., K. Fischer, D. R. Dean.1995. Nitrogenase structure and function: a biochemical-genetic perspective. Annu. Rev. Microbiol. 49: 335-366.
Rossen L., E. (). Davis, A. W. B. Johnston. 19K7. Plant-induced expression of Rhizobium genes involved in host specificity and early stages of nodulation. Trends BioL Sei. 12:430-433.
Schnider U., C. Keel, C. Blumer, J. Troxler, G. Defago, D.Haas. 1995. Amplification of the housekeeping sigma factor in Pseudomonas fluorescents CHAO enhances antibiotic production and improves biocontrol abilities. / BacterioL 177: 5387-5392.
Spaink H. P., C. A. Wijflelrnan, E. Pees, R. J. H. Okker, B. J. J. Lugtenberg.1987. Rhizobium nodulation gene nodD as a determinant of host specificity. Nature 32$: 337-340.
Sprent J. 1.1986. Benefits of Rhizobium to agriculture. Trends Biotechnol. 4: 124-129.
Stacey G. 1995. Bradyrhizobium japonicum nodulation genetics. FEMS Microbiol. Lett. 127: 1-9.
Sun X., M. Griffith, J.J. Pasternak, B. R. Click. 1995. Low temperature growth, freezing survival
330 ГЛАВА 14
and production of antifreeze protein by the plant growth-promoting rhizobacterium Pseudomonas putida GR12-2. Can. J. MicrobM. 41:776-784. van Rhijn P., J. Vanderleyden. 1995. The Rhizobium-plant symbiosis. Microbiol. Rev. 59: 124—142.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Предположим, что у вас есть штамм Rhizobium japonicum, способный усваивать азот и вступающий в симбиотические отношения с растениями сои. Какой подход вы использовали бы для идентификации кластера генов, кодирующих образование клубеньков, при условии, что у вас нет зонда для гибридизации с nod-генами?
2. Что такое гидрогеназа? Как с ее помощью можно повысить урожайность люцерны?
3. Предложите стратегию идентификации всех генов Azotobacter vinelandii, участвующих в связывании азота, имея в виду, что у вас нет nif-генов других микроорганизмов, которые можно было бы использовать в качестве гибридизационных зондов.
4. Как, по вашему мнению, повлияет внесение мутаций в nifA- или nifL-гены на количество фиксируемого данным организмом азота?
5. Обсудите возможность создания рекомбинантных растений, способных фиксировать азот.
6. Предложите схему выделения генов гидрогеназы.
7. Что такое сидерофоры? Каким образом, модифицируя гены сидерофоров, можно повысить способность бактерий стимулировать рост растений?
8. Предложите схему идентификации генов биосинтеза сидерофоров.
9. В чем преимущество микробиологических удобрений перед химическими?
10. Как с помощью методов генной инженерии повысить эффективность Agrobacterium radiobacter как инструмента биоконтроля?
11. Какие ферменты, секретируемые стимулирующими рост растений бактериями, обусловливают их «биоконтролирующие» свойства? Каков механизм действия этих ферментов?
ГЛАВА 15.
Микробные инсектициды
Из всех классов животных класс насекомых — самый многочисленный: число описанных видов приближается к 1 млн. Насекомые могут наносить огромный ущерб урожаю сельскохозяйственных культур, а некоторые из них являются переносчиками болезней человека и животных. В 1940-х тт. было синтезировано множество химических инсектицидов, позволяющих контролировать численность популяций насекомых-вредителей. Самым известным из них был дихдордифенилтрихлорэтан (ДДТ). Это хлорорганическое соединение синтезировали в 1870-х гг., но в качестве инсектицида стали применять лишь в конце 1930-х гг. ДДТ оказался высокоэффективным средством борьбы со многими насекомыми-вредителями. Как и другие хлорорганические соединения, он оказывает парализующее действие на нервную систему и мышечные ткани насекомых. К настоящему времени синтезированы и широко применяются другие хлорорганические соединения, такие как дильдрин, альдрин, хлордан, линдан, токсофен.
Еще один класс химических инсектицидов — фосфорорганические соединения, включающие малатион, паратион и диазинон. Фосфорорганические инсектициды первого поколения были разработаны как боевые отравляющие вещества. Теперь их используют для контроля численности насекомых. Их действие основано на ингибировании ацетилхолинэстеразы, которая гидролизует нейромедиатор ацетилхолин. Инсектициды этого класса нарушают функционирование мотонейронов и нейронов мозга насекомого.
В США к началу 1960-х гг. химическими инсектицидами обрабатывалось около 50 млн. га сельскохозяйственных угодий. Примерно в это время было показано, что хлорорганические (в большей степени) и фосфорорганические (в меньшей степени) инсектициды оказывают вредное воздействие на человека, животных и экосистемы. Это воздействие может проявляться немедленно или спустя длительное время. Хлорорганические соединения (в частности, ДДТ) сохраняются в окружающей среде от 15 до 20 лет и накапливаются во все возрастающих концентрациях. Биоаккумуляция химических инсектицидов в жировых тканях многих организмов уже привела к пагубным последствиям. Так, в Северной Америке были практически истреблены многие виды птиц: сапсаны, ястребы-перепелятники, белоголовые орланы, бурые пеликаны, ушастые бакланы.
Со временем основные насекомые-вредители становились все более устойчивыми ко многим химическим инсектицидам, и это привело к тому, что к 1950-м гг. для контроля их численности пришлось использовать более высокие концентрации инсектицидов. Кроме того, было показано, что химические инсектициды действуют не избирательно, т. е, наряду с насекомыми-вредителями они уничтожают и полезных насекомых, а в некоторых случаях гораздо эффективнее уничтожают естественных врагов насекомых-вредителей, чем самих вредителей. Зачастую это приводило к весьма неожиданным результатам; обработка вызывала увеличение численности насекомых-вредителей.
С учетом этого все последние 20 лет проводились интенсивные поиски альтернативных способов контроля численности насекомых-вредителей. Прежде всего исследователи обратились к
332 ГЛАВА 15
природным инсектицидам, синтезируемым различными микроорганизмами и растениями. Дело в том, что эти соединения, как правило, высокоспецифичны и подвергаются быстрой биодеградации, поэтому устойчивость к ним вырабатывается медленно. К сожалению, они не очень эффективны, а их получение обходится дорого, что ограничивает возможность их широкого применения. Есть надежда, что все эти проблемы удастся решить с помощью технологий рекомбинантных ДНК. Теперь для увеличения эффективности микробиологических инсектицидов исследователи могут проводить манипуляции с генами, которые кодируют их биосинтез, В частности, речь может идти о генах инсектицидов, вырабатываемых бактерией Bacillus thuringiensis или бакуловирусами насекомых; эти инсектициды безопасны, специфичны и весьма эффективны.
Рынок пестицидов огромен: в настоящее время на их производство во всем мире ежегодно расходуется более 20 млрд. долларов, и эта цифра быстро растет. При этом на долю биопестицидов, главным образом инсектицидов В. thuringiensis, приходится всего 1% этой суммы, но по прогнозам дальнейший прогресс в этой области будет связан именно с биопестицидами.
Токсин, синтезируемый Bacillus thuringiensis
Механизм действия и использование
Под «микробным инсектицидом» иногда понимается микроорганизм, либо синтезирующий какое-либо токсичное вещество, избирательно действующее на определенных насекомых, либо инфицирующий насекомое-мишень и приводящий к его гибели. Наиболее изученные, наиболее эффективные и наиболее часто используемые микробные инсектициды — бактерии В. thuringiensis. Они представлены множеством штаммов и подвидов (subsp.), и каждый из них синтезирует токсин, специфичный в отношении определенных насекомых (табл. 15.1). Например, В. thuringiensis subsp. kurstaki токсичен для личинок чешуекрылых (в том числе моли и бабочек), для личинок толстоголовки, мермитид и гусениц листовертки-почкоеда елового. В. thuringiensis subsp. ismelensis уничтожает двукрылых: комаров и мошек. В. thuringiensis subsp. tenebrionis (также известный как son diego) эффективен в отношении жесткокрылых, в том числе колорадского жука и хлопкового долгоносика. Описаны и другие штаммы В. thuringiensis, каждый из которых токсичен для определенных насекомых.
Инсектицид (белковый токсин) В. thuringiensis subsp. kurstaki и других штаммов находится в клетке в виде так называемого параспорального кристалла — структуры, которая образуется во время споруляции бактерий. Никакой особенной биологической функции эта структура не несет. На ее долю приходится от 20 до 30% сухой массы спорулирующей культуры и состоит она главным образом из белка (~95%) и некоторого количества углеводородов (-5%). Кристалл — это на самом деле некий белковый агрегат, диссоциирующий на субъединицы в слабой щелочи. Субъединицы можно далее диссоциировать in vitro обработкой ß-меркаптоэтанолом, кото-
| Таблица 15.1. Некоторые свойства инсектицидных токсинов, синтезируемых разными штаммами В. thuringiensis1) | ||||
| Штамм В. thuringiensis или подвид | Класс | Мол. масса протоксина, кДа | Насекомое-мишень | Серотип |
| berliner | CryI | 130-140 | Чешуекрылые | |
| kurstaki КТО, HD-1 | CryI | 130-140 | Чешуекрылые | |
| entomocidus 6.01 | CryI | 130-140 | Чешуекрылые | |
| αizawai 7.29 | CryI | 130-140 | Чешуекрылые | |
| aizawai IC 1 | CryI | Чешуекрылые, двукрылые | ||
| kurstaki HD-I | CryII | Чешуекрылые, двукрылые | ||
| tenebrionis (san diego) | CryIII | 66-73 | Жесткокрылые | |
| morrisoni PG 14 | CryIV | 125-145 | Двукрылые | |
| israelensis | CryIV | Двукрылые | ||
| 1) Из работы Lerechus el al., p. 37— 69, in Enlwistle et al., (ed.). Bacillus thuringiensis, an Environmental Biopesticide: Theory und Practice, 1993. |
Микробные инсектициды 333
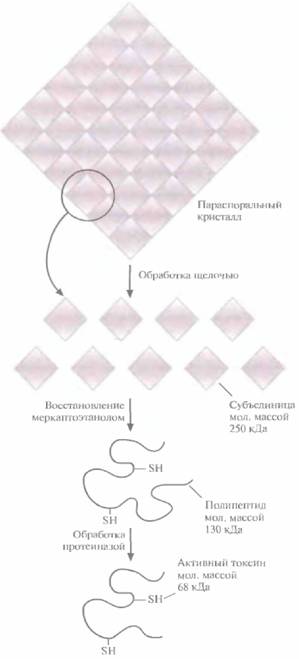
| Рис. 15.1. Схематическое изображение параспорального кристалла В. thuringiensis, состоящего из белкового протоксина Cryl. Каждая белковая субъединица имеет мол. массу 250 кДа и содержит два полипептида мол. массой 130 кДа каждый. Молекулярные массы определяли с помощью электрофореза в полиакриламидном геле; приведены округленные значения. Превращение протоксина (130 кДа) в активный токсин (68 кДа) происходит только в слабощелочных условиях (pH 7,5—8) в присутствии специфической протеиназы (протеиназ). Именно эти условия реализуются в кишечнике насекомого. |
рый восстанавливает дисульфидные связи (рис. 15.1).
Все инсектицидные токсины, выделенные из множества штаммов В. thuringiensis, в соответствии с их токсичностью можно сгруппировать в четыре основных класса: CryI, CryII, CryIII и CryIV, Белки Cryl токсичны для чешуекрылых, CryII - для чешуекрылых и двукрылых, Crylll -для жесткокрылых, CrylV — для двукрылых. Классы можно разделить далее на подклассы (А, В, С, ...) и подгруппы (а, b, с, ...) согласно нуклеотидным последовательностям генов соответствующих токсинов. Например, класс генов cryI включает шесть подклассов (от crylA до F), а подкласс crylA — три подгруппы [от crylA(a) до (с)]. Кроме того, в соответствии с иммунологическими особенностями выделяют примерно 30 разных серотипов В. thuringiensis ( табл. 15.1). Каждый серотип отличается от другого специфическим набором антигенных детерминант на поверхности клеток определенного штамма В. thuringiensis.
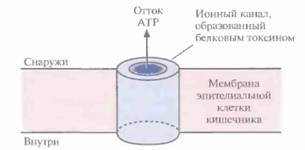
В параспоральном кристалле инсектицид обычно находится в неактивной форме; при солюбилизации кристалла белок высвобождается в форме протоксина, предшественника активного токсина. Протоксин класса токсинов Cryl имеет мол, массу примерно 130 кДа (рис. 15.1). После заглатывания насекомым параспорального кристалла протоксин активируется в кишечнике в условиях щелочного pH (7,5—8,0) и под действием специфических пищеварительных протеиназ превращается в активный токсин с мол. массой примерно 68 кДа (рис. 15.1). В таком виде он встраивается в мембрану эпителиальных клеток кишечника насекомого и образует ионный канал, через который, как полагают, происходит утечка значительной части клеточного АТР (рис. 15.2). Примерно через 15 мин после формирования такого ионного канала клеточный метаболизм блокируется, насекомое перестает питаться, происходит обезвоживание
334 ГЛАВА 15
|
| Рис. 15.2. Встраивание токсина В, thuringiensis в мембрану эпителиальной клетки кишечника насекомого и образование ионного канала. |
организма и в конечном счете наступает смерть. Поскольку превращение прстоксина в активный токсин происходит только в условиях щелочного pH и в присутствии определенных протеиназ, вероятность вредного воздействия токсинов на человека и сельскохозяйственных животных мала.
Способ действия токсинов В. thuringiensis налагает некоторые ограничения на область их применения. Чтобы убить насекомое, В. thuringiensis обязательно должен попасть в его кишечник, в противном случае никакого эффекта не будет. В. thuringiensis чаще всего распыляют, причем бактерии обычно смешивают с атрактантами насекомых, чтобы повысить вероятность того, что насекомое-вредитель проглотит токсин. Однако для насекомых, обитаюших в тканях растений или на корнях, токсин В. thuringiensis при такой обработке вряд ли будет представлять какую-либо опасность. С учетом всего этого были предприняты попытки разработать другие стратегии защиты растений от таких вредителей. Один из подходов состоит в создании трансгенных растений, несущих и экспрессирующих ген токсина В. thuringiensis и, следовательно, защищенных от насекомых-вредителей в течение всего периода вегетации.
Второе ограничение, налагаемое на применение токсина В. thuringiensis, связано с тем, что этот токсин действует на насекомое, находящееся только на определенной стадии развития. Именно в этот момент и должна проводиться обработка.
Штамм В. thuringiensis subsp. kurstaki был выделен в 1901 г., но интерес к нему как к ценному коммерческому продукту возник лишь в 1951 г., а за последние десять лет эта бактерия стала основным инструментом контроля численности гусениц листовертки-почкоеда елового в Канаде. В 1979 г. лишь над 1% лесов Канады, обрабатываемых инсектицидами с целью уничтожения этого насекомого (что соответствует примерно 2 млн. га), распыляли В. thuringiensis subsp. kurstaki; остальные площади обрабатывали химическими инсектицидами. К !986 г. масштабы использования B. thuringiensis subsp. kurstaki возросли до 74%. В других странах В. thuringiensis subsp. kurstaki используют для борьбы с коконопрядом, непарным шелкопрядом, мертимидами, совкой капустной и бражником. Основное препятствие на пути еще более широкого применения В. thuringiensis subsp. kurstaki состоит в его дороговизне: стоимость такого препарата в 1,5—3 раза выше, чем химических инсектицидов.
Для биоконтроля численности насекомых-вредителей распыляют 1,5 - 109 — 2,5 109 спор В. thuringiensis subsp. kurstaki на каждый квадратный метр обрабатываемого участка. Обработку проводят в тот период, когда число личинок в популяции насекомого-мишени максимально, поскольку параспоральные кристаллы чувствительны к солнечному свету и быстро разрушаются. В лабораторных условиях на свету за 24 ч разлагается более 60% остатков триптофана в белках па-распорального кристалла, а в окружающей среде в зависимости от освещенности кристаллы могут сохраняться от одних суток до одного месяца. Такая нестабильность инсектицидного протоксина подразумевает, что появление устойчивых к нему насекомых маловероятно.
Однако в том случае, когда В. thuringiensis subsp. kurstaki использовали в качестве инсектицида в условиях малой освещенности (например, в зернохранилищах), через несколько генераций появлялись устойчивые к токсину насекомые. Одна из причин такой передаваемой по наследству устойчивости заключается в изменении мембранного белка клеток кишечника, в норме выполняющего функцию рецептора токсина В. thuringiensis subsp. kurstaki. Возможно, она возникает вследствие того, что в этих условиях протоксин не разрушается и служит фактором отбора. Из всего этого следует, что появления насекомых, устойчивых к В. thuringiensis
Микробные инсектициды 335
subsp. kurstaki, проще всего избежать, если ограничить применение данного микроорганизма полевыми условиями. Впрочем, имея в виду масштабы использования В. thuringiensis, нельзя исключить, что может произойти его накопление в среде в количестве, достаточном для того, чтобы вступил в действие механизм отбора. А поскольку B. thuringiensis используется все более широко в разных регионах, вероятность появления популяций устойчивых насекомых будет увеличиваться.
Идентификация генов токсинов
Для создания штаммов В. thuringiensis, более эффективно синтезирующих инсектициды и имеющих широкий круг хозяев, нужно было идентифицировать и охарактеризовать ген(ы) протоксина, и в первую очередь выяснить, где они локализованы: в плазмиде или в хромосомной ДНК. Чтобы проверить гипотезу плазмидной локализации, штамм В. thuringiensis, продуцирующий токсин, можно конъюгировать со штаммом, не обладающим инсектицидной активностью. Передача хромосомной ДНК во время конъюгации происходит крайне редко, и если «дефектный» штамм приобретает способность синтезировать инсектицид, значит, токсиновые гены локализованы в плазмиде.
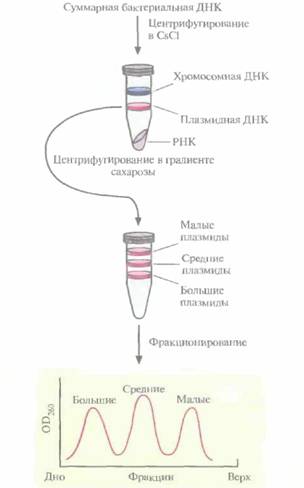
Для идентификации гена, кодирующего протоксин , используют обычную методику. В. thuringiensis выращивают в культуре и лизируют клетки. Выделяют суммарную клеточную ДНК и центрифугируют ее в градиенте плотности CsCl, чтобы разделить плазмидную и хромосомную ДНК. Если гены протоксинов входят в состав генома, создают банк клонов хромосомной ДНК. Если же они содержатся в плазмиде, то плазмидную ДНК фракционируют по размерам центрифугированием в градиенте плотности сахарозы. Это обогащает ту плазмидную фракцию, которая послужит в дальнейшем исходным материалом для идентификации генов протоксинов (рис. 15.3).
Ген протоксина B. thuringiensis subsp. kurstaki находится на одной из семи плазмид длиной 2,0; 7,4; 7,8; 8,2; 14,4; 45 и 71 т. п. н. Чтобы определить, в какой именно, проводили центрифугирование плазмидной ДНК в градиенте плотности сахарозы. Были выделены три фракции, в кото-
|
| Рис. 15.3. Выделение и фракционирование плазмид, одна из которых несет ген протоксина. |
рых концентрировались малые (2,0 т. п. н.), средние (7,4; 7,8; 8,2 и 14,4 т. п. н.) и большие (45 и 71 т. п. н.) плазмиды. Малые плазмиды из рассмотрения были исключены, поскольку они не могли кодировать белок мол. массой 130 кДа. Длина нуклеотидной последовательности, кодирующей белок такого размера, должна превышать 4,0 т. п. н. Средние и большие плазмиды подвергли частичному гидролизу рестрицирующей эндонуклеазой Sau3АI и фрагменты встроили в BamHI-сайт плазмиды pBR322. Полученными рекомбинантными плазмидами трансформировали клетки E. соli, а затем провели иммунологический скрининг по следующей схеме:
336 ГЛАВА 15
1. Колонии клеток перенесли с агара на нитроцеллюлозный фильтр.
2. Перенесенные клетки частично лизировали органическими растворителями.
3. Все сайты неспецифического связывания первых и вторых антител на фильтре блокировали с помощью бычьего сывороточного альбумина (БСА).
4. Обработанные БСА фильтры инкубировали с кроличьими антителами к искомому инсектициду.
5. Отмывали фильтры от несвязавшихся антител и обрабатывали 125I-меченным А-белком Staphylococcus aureus, который взаимодействует с Fc-фрагментом связанных антител.
6. Области на фильтре, которые соответствуют колониям, активно синтезирующим инсектицид, выявляли с помощью радиоавтографии.
Используя идентифицированный ген протоксина в качестве гибридизационного зонда, установили, что соответствующая нуклеотидная последовательность содержится в плазмиде В. thuringiensis subsp. kurstaki длиной 71 т. п. н. Аналогичная схема клонирования и скрининга использовалась для идентификации генов токсинов, локализованных в плазмидах или (реже) в хромосомной ДНКдругих штаммов В. thuringiensis.
Генная инженерия генов токсинов В. thuringiensis
После идентификации токсинового гена В. thuringiensis была определена первичная структура кодируемого им белка. Сравнен ие аминокислотных последовательностей разных белковых токсинов показало, что белки некоторых штаммов имеют одинаковый домен, ответственный за токсичность. Кроме того, был субклонирован сегмент полной кодирующей последовательности, с которого синтезировался укороченный белок, в полной мере сохранивший свою токсичность. Таким образом, при последующих генноинженерных манипуляциях могут использоваться интактный ген токсина, его фрагмент или химически синтезированный олигонуклеотид.
В естественных условиях большинство протоксинов В. thuringiensis синтезируются только во время споруляции, т. е. параспоральный кристалл образуется только на определенной стадии развития микроорганизма. Если бы экспрессия гена токсина происходила во время всего жизненного цикла, можно было бы существенно увеличить количество получаемого токсина и уменьшить время его синтеза. Кроме того, это позволило бы сделать синтез токсина непрерывным процессом и тем самым значительно удешевить продукт, поскольку для непрерывной ферментации используют небольшие, а потому менее дорогие биореакторы и оборудование, чем для периодической (более подробно см. об этом в гл. 16).
Во время споруляции В. thuringiensis специфический фактор инициации транскрипции (сигма-фактор) связывается с промоторами генов, функционирующих только на этой стадии жизненного цикла бактерии, так что синтезируются матричные РНК (мРНК), специфичные для споруляции. Следовательно, чтобы добиться непрерывной экспрессии инсектицидного гена (генов) В. thuringiensis, необходимо поместить его (их) под контроль промотора, функционирующего в течение всего жизненного цикла.
Для этого фрагмент ДНК. содержащий ген токсина без его собственного промотора, встроили в плазмиду так, чтобы он находился под контролем активного конститутивного промотора гена устойчивости к тетрациклину, который ранее был вырезан из плазмиды Bacillus cereus и введен в В. thuringiensis. На всех этапах развития микроорганизма непрерывно синтезировался полноценный токсичный белок (рис. 15.4). Кроме того, когда этой конструкцией трансформировали мутантный штамм В. thuringiensis, не способный к споруляции, токсин все равно синтезировался. При этом процесс был гораздо более эффективным, чем в случае В, thuringiensis дикого типа: количество получаемого продукта было больше, а израсходованное количество субстрата и время синтеза -значительно меньше.
Дальнейшее усовершенствование этой системы могло бы состоять во введении токсинового гена, экспрессирующегося в течение всего жизненного цикла, в хромосомную ДНК штамма В. thuringiensis, не способного к споруляции. Это гарантировало бы сохранность гена при непрерывной ферментации, что не всегда достигается
Микробные инсектициды 337
| Рис. 15.4. Клонирование фрагмента гена токсина В. thuringiensis subsp. kurstaki под контролем промотора гена устойчивости к тетрациклину (pTet). Из выделенного гена В. thuringiensis удаляют его собственный промотор с помощью рестриктаз RE1 и RE2. Полученный фрагмент встраивают в плазмидный вектор рядом с промотором pTet вместо гена устойчивости к тетрациклину, удаленного с помощью рестриктаз RE1 и RE2, и лигируют при участии ДНК-лигазы фага Т4. | 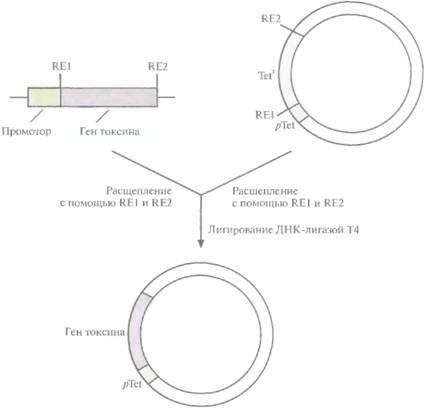
|
при его плазмидной локализации вследствие нестабильности плазмиды.
В отличие от большинства других токсиновых генов (cry) В. thuringiensis, экспрессия гена cryIIIA в норме контролируется «негативным» промотором, а не промотором, специфичным для споруляции. Ген cryIIIA кодирует токсин, эффективный в отношении личинок жесткокрылых. В результате трансформации мутантного штамма В. thuringiensis, не способного образовывать споры, плазмидой, несущей клонированный ген crуIIIА, токсин синтезировался более эффективно и был более стабильным, чем при его синтезе в штамме дикого типа. Получив этот результат, ученые предположили, что суперэкспрессии других cry-генов, обычно экспрессирующихся только во время споруляции, можно достичь, если поместить их под контроль промотора cryIIIA и трансформировать получившейся конструкцией мутантный штамм В. thuringiensis) не способный к споруляции.
Урожаю многих сельскохозяйственных культур наносят ущерб сразу несколько видов насекомых, поэтому чрезвычайно полезным было бы создание микробиологических инсектицидов, направленных против широкого спектра насекомых-вредителей. Токсин широкого спектра действия можно получить двумя путями: 1) переносом гена данного токсина (например, токсина, эффективного в отношении двукрылых) в штамм В. (thuringiensis, синтезирующий другой видоспецифичный токсин (например, эффективный в отношении жесткокрылых); 2) соединением частей двух генов разных видоспецифичных токсинов с образованием последовательности, кодирующей уникальный токсин двойного действия (гибридный токсин).
Чтобы проверить возможность получения токсина с широким спектром действия, встроили гены токсинов В. thuringiensis subsp. aizawai и tenebrionis в челночные векторы, способные реп-
Дата добавления: 2015-07-14; просмотров: 1374;
