Внутренняя энергия и ее основное свойство.
Термодинамика. Лекция 2.
К.т.н. Прохоренко Н.Н.
Расчет основных термодинамических величин ΔU, Q, W.
В предыдущей лекции первый закон термодинамики, будучи специализированной формой записи закона сохранения энергии, был записан в виде:
du = Tds – pdv (2.1)
Здесь приращение внутренней энергии выражено через параметры состояния рабочего тела: термические T и s и деформационные р и v. Первое слагаемое в (2.1) справа представляет собой количество термического взаимодействия между внешней средой и рабочим телом dq = Tds, т.е. количество теплоты, подведенной (отведенной) к рабочему телу. Второе – количество деформационного взаимодействия между внешней средой и системой, т.е. работу сжатия (расширения) dw = pdv. Поэтому иногда удобно записывать первый закон термодинамики (2.1) в виде:
du = dq – dw, (2.2)
где слева характеристика энергии системы, а справа – количества воздействий внешней среды на систему.
В основном уравнении термодинамики (2.2) фигурируют три величины. Чтобы это уравнение стало расчетным инструментом термодинамики, необходимо дать правила независимого расчета по крайней мере двух величин из трех, входящих в (2.2). Начнем с анализа функции u(s,v).
Термодинамические характеристические функции
(функции состояния).
Внутренняя энергия и ее основное свойство.
Рассмотрим интеграл по замкнутому контуру (циклу) от основного уравнения (2.2)
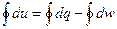
и обратимся к рисунку (2.1).
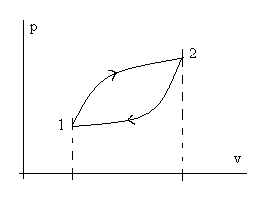
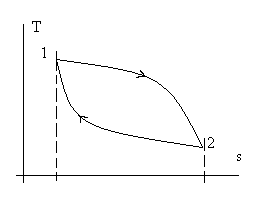
Рис. 2.1. Иллюстрация к пояснению полноты дифференциала du.
Пусть процесс начинается в состоянии (точке) 1, доходит до состояния (точки) 2 и завершается снова в точке 1. Из определения понятия уравнения состояния следует, что
T = T(s,v) и p = p(s,v).
Эти же аргументы относятся к функции (см. (2.1)) u = u(s,v), т.е. u(∙) зависит только от координат (параметров) состояния s и v термодинамической системы, и это естественно с физической точки зрения – ее возврат в исходное состояние (точка 1), где внутренняя энергия имеет только одно определенное значение. Следовательно, для замкнутых (круговых) процессов – в термодинамике они названы циклами:
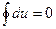 (2.3)
(2.3)
Поэтому из математического анализа (из теории функций многих переменных) следует, что du –полный дифференциали изменение функции Δu влюбом процессе 1 - 2
u2 –u1 = 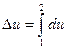 (2.4)
(2.4)
или в графической форме - при переходе от точки 1 к точке 2 - не зависит от траектории процесса перехода из точки в точку (см. рис 2.2), а в действительных явлениях характер процесса не влияет на изменение внутренней энергии – оно определяется только состоянием (параметрами) в начале и конце процесса.
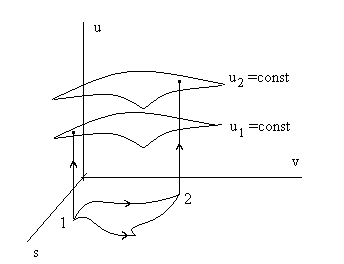
Рис. 2.2. Изменение внутренней энергии u(s,v) не зависит
от траектории F(s,v) = 0 перехода из точки 1 в точку 2.
Определение.Величины (функции), изменение которых не зависят от характера процесса, а определяются только состояниями (параметрами) начала и конца процесса, называются функциями состояния.
Дата добавления: 2015-08-21; просмотров: 1101;
