ГЛАВА 4. Технология рекомбинантных ДНК включает целый набор экспериментальных процедур, благодаря которым удается выделить (клонировать) фрагменты ДНК
ЗАКЛЮЧЕНИЕ
Технология рекомбинантных ДНК включает целый набор экспериментальных процедур, благодаря которым удается выделить (клонировать) фрагменты ДНК, содержащие специфические гены. Успех клонирования зависит от возможности воспроизводимо разрезать молекулу ДНК на фрагменты определенного размера. Для точного расщепления ДНК используют рестрици-рующие эндонуклеазы типа 11. Эти ферменты узнают специфические нуклеотидные последовательности и симметрично разрезают фосфодиэфирные связи в каждой цепи.
Типичный эксперимент по клонированию генов включает следующие этапы. 1. Рестриктазное расщепление ДНК, выделенной из организма, который содержит искомый ген. 2. Обработка вектора для клонирования (обычно плазмидного). который может реплицироваться в клетке-хозяине, теми же рестриктазами, которые использовались для расщепления донорной ДНК. 3. Смешивание этих двух образцов ДНК и сшивание фрагментов ДНК-лигазой фага Т4. 4. Трансформация сшитыми молекулами клеток-хозяев. Амплификация рекомбинантной ДНК в трансформированных клетках.
Для отбора клеток, содержащих рекомбинантную ДНК, используют специальные приемы. Чтобы уменьшить количество кольцевых плазмидных молекул, образующихся при сшивании фрагментов ДНК-лигазой Т4, рестрици-рованную плазмидную ДНК обрабатывают щелочной фосфатазой, удаляющей 5'-концевые фосфатные группы. Для отбора трансформированных клеток, содержащих гибридные плазмиды, проводят: 1) тестирование на резистент-ность к определенным антибиотикам или колориметрическую реакцию; 2) иммунологические тесты или выявление специфического белка — продукта клонированного гена; 3) гибридизацию с зондом, комплементарным какому-либо участку искомого гена.
Чтобы иметь возможность клонировать целый ген, донорную ДНК расщепляют лишь частично. При этом получаются фрагменты разной длины, из которых затем создают геномную библиотеку. Для клонирования крупных фрагментов ДНК были сконструированы векторы на основе бактериофагов λ и Р1, а также плазмиды F.
Для получения фрагментов ДНК, кодирующих эукариотические белки, на очищенной мРНК как на матрице синтезируют комплементарную цепь ДНК с помощью обратной транскриптазы; эта цепь в свою очередь используется в качестве матрицы для синтеза второй цепи. После ферментативной обработки эту двухцепочечную комплементарную ДНК встраивают в вектор.
Независимо от того. Какая именно стратегия клонирования используется, после идентификации клонированной последовательности необходимо показать, что она представляет собой нативный структурный ген.
ЛИТЕРАТУРА
Berger S. L, A. R. Kimmel(ed.). 1987. Methods in Enzymotogy, vol. 152. Guide to Molecular Cloning Techniques. Academic Press, London, United Kingdom.
Garfin D. E. 1995. Electrophoretic methods, p. 53-109. In ]. A. Glasel and M. P. Deutscher (ed.), Introduction to Biophysical Methods for Protein and Nucleic Acid Research. Academic Press, San Diego, Calif.
Grinstead J.t P. M. Bennett(ed.)· 1988. Methods in Microbiology, vol. 21, Plasmid Technology. Academic Press, London, United Kingdom.
loannou A. P., C. T.Amemiya, J. Games, P. M. Kroisel, H. Shizuya, C. Chen, M. A. Batzer, P. J. de Jong.1994. Anew bacteriophage-derived vector for tlie propagation of large human DNA fragments. Nat. Genet. 6: 84-89.
Kim U.-J., B. W. Birren, T.Slepak, V. Mancino, C.Boysen, H.-L. Kang, M. I. Simon, H. Shizuya.1996. Construction and characterization of a human bacterial artificial chromosome library. Genomics34: 213—218.
Leonardo E. D., J. M. Sedivy.1990. A new vector for cloning large eukaryotic DNA segments in Escherichia coli. Bio/Technology 8: 841 —844.
Martin C., L. Bresnick, R.-R. Juo, J. C.Voyta, L Bronstein.1991. Improved chemiluminescent DNA sequencing, BtoTechniques 11:110-114.
Old R. W., S. B. Primrose,1985. Principles of Gene Manipulation, 3rd ed. Blackwell Scientific Publications, Oxford, United Kingdom.
Sambrook JM E. F. Fritsch, T. Maniatis.1989. Molecular Cloning: a Laboratory Manual, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.
Технология рекомбинантных ДНК 79
Slightom J. L., R. F. Drong, P. P. Chee.1993. Construction of λ clone banks, p. 121—146. In B. R. Click and J. E. Thompson (éd.), Methods in Plant Molecular Biology and Biotechnology. CRC Press, Boca Raton, Fla.
Southern E.1975. Detection of specific sequences among DNA fragments separated by gel elec-trophoresis. J. Mol. Biol. 98: 503-507.
Winnacker E.-L.1987. From Genes to Clones: Introduction to Gene Technology. VCH, New York, N.Y.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое эндонуклеазы рестрикции типа II и почему они так важны для технологии рекомбинантных ДНК?
2. При обработке кольцевой двухцепочечной плазмиды pCELl различными рестриктазами и их комбинациями получаются следующие фрагменты (размеры указаны в парах нуклео-тидов): EcoRI - 6,0; ВатIII - 6,0; HindIII -6,0; НаеII - 3,0; 2,0 и 1,0; EcoRI и НаеII - 2,0 и 1,0; EcoRI и HindIII - 3,5 и 2,5; EcoRI и ВатHI - 4,5 и 1,5; ВатHI и HindIII - 5,0 и
1,0; ВатШ и Haell - 3,0; 1,5 и 0,5; HindIII и НаеII — 3,0; 1,5; 1,0 и 0,5. Используя эти данные, постройте рестрикционную карту pCELl.
3. Опишите применение плазмиды pBR322 в качестве вектора. Какими особенностями она обладает?
4. Опишите основные свойства системы клонирования pUC.
5. Обычно банк клонов создают лигированием плазмидного вектора, подвергнутого исчерпывающему гидролизу с помощью BamHI, с хромосомной ДНК, частично гидролизован-ной рестриктазой Sau3АI.
а. Почему в этом эксперименте используется два разных фермента?
б. Что такое частичный гидролиз и как его проводят?
в. Почему к нему часто прибегают для создания банков клонов?
6. Зачем рестрицированную плазмидную ДНК перед лигированием часто обрабатывают щелочной фосфатазой?
7. Опишите способы введения рекомбинантных плазмид в грамотрицательную бактерию, например в E. coli.
ГЛАВА 5
Химический синтез, определение нуклеотидной последовательности и
амплификация ДНК
Технологический прогресс в любой области науки всегда стимулирует ее дальнейшее развитие. С появлением новых технологий появляется возможность ставить новые эксперименты и облегчается проведение старых. Становление молекулярной биотехнологии как науки обязано целому ряду технологических разработок; многие из них ныне широко применяются как в крупных исследовательских центрах, так и небольших научных коллективах. Теперь не составляет особого труда химически синтезировать одну молекулу ДНК, определить нуклеотидную последовательность другой и амп-лифицировать с помощью полимеразной цепной реакции третью. Все это стало возможным благодаря той информации, которая была получена в ходе основополагающих исследований как самой ДНК, так и механизма ее репликации. Эти экспериментальные подходы стали неотъемлемой частью молекулярного клонирования -- процедуры, позволяющей выделять из ДНК нужные фрагменты, охарактеризовывать их и производить с ними разнообразные манипуляции.
Химический синтез ДНК
С разработкой быстрых и недорогих методов химического синтеза одноиепочечных ДНК-фрагментов с заданной нуклеотидной последовательностью методология молекулярного клонирования и характеризации ДНК существенно изменилась. Химически синтезированные олигонуклеотиды можно использовать для конструирования целых генов или их фрагментов, для амплификации специфических фрагментов ДНК, для направленных мутаций изолированных ДНК, а также в качестве зондов при гибридизации и в качестве линкеров, облегчающих клонирование.
С появлением приборов для автоматического химического синтеза ДНК (ДНК-синтезаторов) получение одноцепочечных олигонуклеотидов длиной <50 звеньев стало более или менее рутинной процедурой. Основным компонентом любого ДНК-синтезатора является система клапанов и насосов, с помощью которых в реакционную смесь по строго заданной программе вводятся нуклеотиды и реагенты, обеспечивающие присоединение нужных мономерных единиц к растущей цепи. В отличие от биологического, в ходе химического синтеза ДНК каждый новый нуклеотид можно присоединять к 5'-гидроксильному концу цепи. Все реакции осуществляются последовательно в одной реакционной колонке, а продолжительность каждой из них и время отмывания контролируются с помощью компьютера.
Фосфорамидитный метод
В настоящее время это наиболее распространенный метод химического синтеза ДНК. Исходными строительными блоками в нем являются модифицированные дезоксирибонуклеозиды. Модификация состоит в присоединении к аминогруппам дезоксиаденозина и дезоксицитидина бензольной группы, а к аминогруппе дезоксигуанозина — изобутирильной. Тимидин, у которого отсутствует аминогруппа, не модифицируют. Такая модификация необходима для защиты нуклеозидов от нежелательных побочных реакций при росте цепи. Синтез осуществляют в
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 81
твердой фазе (растущая цепь ДНК фиксируется на твердом носителе), что позволяет проводить все реакции в одной емкости, легко отмывать после каждого этапа ненужные реагенты и добавлять новые в количестве, обеспечивающем возможно полное протекание реакции.
Этапы многоступенчатого синтеза представлены на рис. 5.1. Первый нуклеозид (азотистое основание + сахар) фиксируют на инертном твердом носителе, обычно это пористые стеклянные шарики с порами одинакового размера. 3'-гидроксильная группа первого нуклеозида, который будет 3'-концевым нуклеотидом синтезируемой цепи, прикрепляется к спейсерной молекуле, ковалентно связанной с носителем. Чтобы предотвратить неспецифическое взаимодействие 5'-гидроксильной группы первого нуклеотида до добавления в реакционную смесь второго нуклеотида, ее защищают с помощью диметокситритильной (ДМТ) группы (рис. 5.2). Такую группу содержит каждый присоединяемый к растущей цепи нуклеотид, а кроме того, он несет диизопропиламинную группу, присоединенную к 3'-фосфитной группе, которая в
| Рис. 5.1. Химический синтез олигонуклеотида. После n циклов образуется одноцепочечный фрагмент ДНК из n + 1 нуклеотида. | 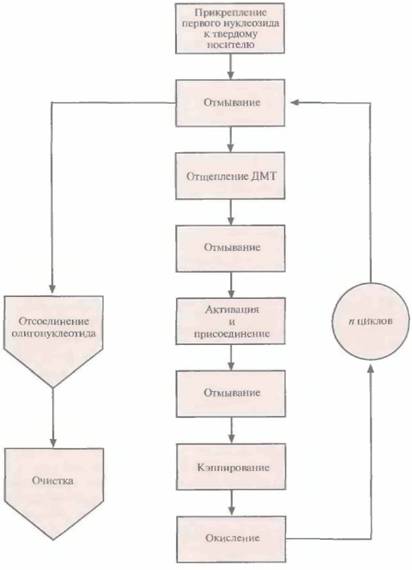
|
82 ГЛАВА 5
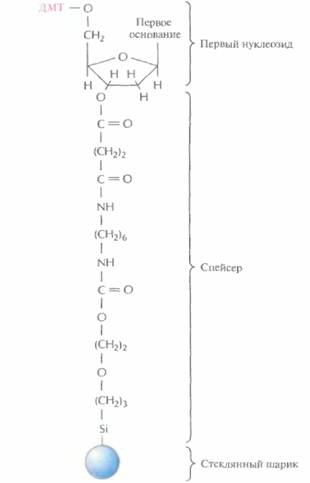
| Рис. 5.2. Комплекс, с которого начинается химический синтез цепи ДНК. К 5'-гидроксильной группе дезоксирибозы первого нуклеозида присоединена ди-метокситритильная (ДМТ) группа, а к 3'-гидроксиль- ной группе — спейсерная молекула. Последняя в свою очередь связана с твердым носителем (пористым стеклянным шариком). |
свою очередь защищена метальным остатком (рис. 5.3). Такая молекулярная конфигурация и называется фосфорамидитом.
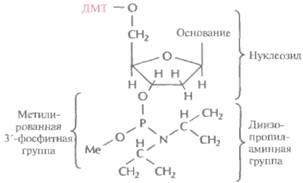
| Рис. S.3. Структурная формула фосфорамидита. Такие производные всех четырех оснований - А, Т, G и С — используются для химическою синтеза ДНК ДМТ — диметокситритил, Me — метальная группа. |
Цикл начинается после присоединения первого нуклеозида к стекляному шарику. Далее колонку обильно промывают каким-либо безводным реагентом (например, ацетонитрилом), чтобы удалить воду и другие нуклеофильные вещества, и продувают через нее аргон для вытеснения ацетонитрила. Затем с помощью трихлоруксусной кислоты (ТХУ) отщепляют 5'-ДМТ (детритилирование) от присоединенного нуклеотида, с тем чтобы высвободить (экспонировать) реакционноспособную 5'-гидроксильную группу (рис. 5.4). Колонку вновь промывают ацетонитрилом для удаления ТХУ и продувают через нее аргон для удаления ацетонитрила. Процесс запрограммирован таким образом, чтобы на втором этапе в колонку одновременно вводились следующий нуклеозид (в виде фосфорамидита) и тетразол (активация и присоединение). Тетразол активирует фосфорамидит, так что 3'-фосфитная группа образует ковалентную связь с 5'-гидроксильной группой первого нуклеозида (рис. 5.5). Невключившийся фосфорамидит и тетразол удаляют продуванием аргона.
Поскольку по окончании первого этапа не все фиксированные на носителе нуклеозиды оказываются связанными с фосфорамидитом, необходимо предотвратить их взаимодействие с нуклеозидом, добавленным на втором этапе. Для этого непрореагировавшую 5'-гидроксильную группу ацетилируют с помощью уксусного ангидрида и диметиламинопиридина (кэппирование) (рис. 5.6). Если этого не сделать, то уже после нескольких циклов синтезируемые олигонуклеотиды будут различаться как по длине, так и по нуклеотидной последовательности.
Фосфиттриэфирная связь, образовавшаяся на втором этапе между нуклеотидами, нестабильна и может разорваться в присутствии кис-
Химическийсинтез,определение нуклеотидной последовательности и амплификацияДНК 83
| Рис. 5.4. Детритилирование — отщепление 5'-диметокситритильной (ДМТ) группы с помощью трихлоруксусной кислоты (ТХУ). | 
|
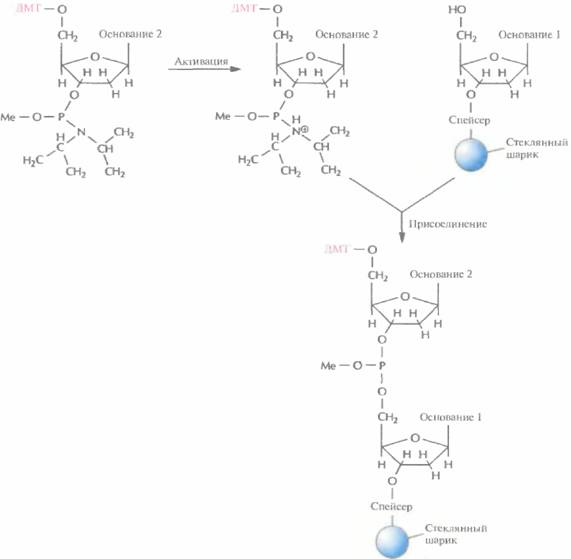
|
| Рис. 5.5. Активация и присоединение, 3'-фосфитная группа активированного фосфорамидита образует ковалентную связь с 5'-гидроксильной группой фиксированного на стеклянном шарике детритилированного нуклеозида. ДМТ — диметокситритильная группа, Me - метильная группа. |
Дата добавления: 2015-07-14; просмотров: 1248;
