ГЛАВА 3. Каждая из них строго специфически связывается своим 3'-концом с одной из 20 аминокислот
Каждая из них строго специфически связывается своим 3'-концом с одной из 20 аминокислот. На 5'-конце тРНК находится последовательность из трех нуклеотидов (антикодон), обеспечивающая связывание тРНК с комплементарным участком из трех нуклеотидов в молекуле мРНК, Существуют две основные разновидности рРНК: малая и большая. Они объединяются соответственно с малой и большой субъединицами рибосомы — особой структуры, в которой и протекает синтез белка. У прокариот молекулы рРНК имеют меньший размер, чем у эукариот.
У прокариот трансляция начинается со связывания мРНК с малой рибосомной субъединицей. Затем происходит комплементарное спаривание первого кодона мРНК с антикодоном инициаторной тРНК (fMet-тΡΗΚ), к образовавшемуся комплексу присоединяется большая ри-босомная субъединица, и образуется комплекс инициации (иниииаторный комплекс), готовый к синтезу полипептидной цепи.
У эукариот трансляция начинается с присоединения инициаторной тРНК, которая несет остаток метионина (Меt-тРНКМеt), к малой рибосомной субъединице; с этой же субъединицей связывается своим 5'-концом мРНК. Малая субъединица перемещается вдоль мРНК до тех пор, пока не дойдет до первого AUG-кодона. Этот кодон образует комплементарную пару с антикодоном UAC инициаторной тРНК. Далее к этому комплексу присоединяется большая субъединица, и образуется рибосома, готовая к синтезу белка.
Элонгация и терминация трансляции у про-и эукариот во многом сходны. После образования инициаторного комплекса следующий кодон мРНК спаривается с антикодоном тРНК, несущей соответствующую аминокислоту (обозначим ее АК2). Первая аминокислота в полипептидной цепи, метионин, отщепляется от тРНК и соединяется с АК2 с помощью пептидной связи. Свободная тРНКМеt покидает рибосому. Рибосомный комплекс перемещается вдоль молекулы мРНК, и пептидил-тРНК, т. е. комплекс Ме1-АК2-тРНКАК2, занимает место, освобожденное отделившейся тРНК. Следующий кодон мРНК спаривается с соответствующим антикодоном тРНК, несущим аминокислоту АК3. АК2 отщепляется от своей тРНК и соединяется с АКЗ с помощью пептидной связи, образуя комплекс Меt-АК2-АК3-тРНКАК3. Освободившаяся от аминокислоты тРН К покидает рибосому. Рибосомный комплекс опять перемещается вдоль молекулы мРНК, и Меt-АК2-АК3-тРНКАК3 занимает вакантное место, занимаемое прежде предыдущей пептидил-тРНК. Эти события повторяются до тех пор, пока рибосома не дойдет до стоп-кодона. Антикодона, который был бы комплементарен стоп-кодону, нет ни у одной из тРНК. Однако стоп-кодон распознается неким белковым фактором освобождения; после присоединения этого фактора к рибосоме связь между последней тРНК и синтезированным полипептидом гидролизуется, тРНК, мРНК и полипептид высвобождаются, а рибосома диссоциирует на субъединицы.
Синтез мРНК и соответственно синтез белка должны строго регулироваться, поскольку у клетки недостаточно ресурсов для одновременной транскрипции и трансляции всех структурных генов. И про-, и эукариоты постоянно синтезируют только те мРНК, которые необходимы для выполнения основных клеточных функций. Экспрессия остальных структурных генов осуществляется под строгим контролем регуляторных систем, запускающих транскрипцию только в том случае, когда возникает потребность в определенном белке (белках). У прокариот транскрипция инициируется связыванием РНК-полимеразы с последовательностями ТАТА и TTGAC промоторной области структурного гена или оперона. Включение или выключение некоторых оперонов осуществляется при участии эффектора, который изменяет конформацию белка-репрессора и препятствует блокированию транскипции. При уменьшении концентрации эффектора в клетке репрессор связывается с участком ДНК, примыкающим к сайту инициации транскрипции, и препятствует перемещению РНК-полимеразы вдоль молекулы ДНК, блокируя таким образом транскрипцию. В других оперонах с участком ДНК, соседствующим с сайтом инициации траскрипции, связывается белок-активатор, который увеличивает скорость транскрипции. Связывание эффектора с активатором может снижать скорость транскрипции, ДНК-белковые взаимодействия, ответственные за регуляцию транскрипции,
ДНК,РНК и синтез белка 49
строго специфичны в отношении определенных структурных генов или оперонов. У эукариот РНК-полимераза II,которая транскрибирует структурные гены, связывается с целым набором белков — факторов транскрипции, которые последовательно присоединяются к ТАТА-последовательности промоторной области. За включение и выключение транскрипции отвечают дополнительные факторы транскрипции, которые связываются с соответствующими участками ДНК.
ЛИТЕРАТУРА
BuratowskiS. 1994. The basics of basal transcription byRNApolymerasell. Cell 77: 1-3.
Kozak M. 1991. Structural features in cukaryotic mRNAs that modulate the initiation of translation. /. Biol. Chem. 266:19867-19870.
Lodish H., D. Baltimore, A. Berk, S.L. Zipursky, P. Matsudaira, J. Darnell. 1995. Molecular Cell Biology. 3rd ed. Scientific American Books, Inc., New York, N.Y.
Nakamura Y., K. Ito, L.A. Isaksson.1996. Emerging understanding of translation termination. Cell 87: 147-150.
Schoenherr C.J., D.J. Anderson. 1995. The neuron-restrictive silencer factor (NRSF): a coordinate represser of multiple neuron-specific genes. Science267i 1360-1363.
Tate W.P., C.M. Brown.1992. Translational termination: "stop" for protein synthesis or "pause" for
regulation of gene expression. Biochemistry 31:2443-2450.
Tjian R., T. Maniatis. 1994, Transcriptional activation: a complex puzzle with few easy pieces. Cell 77: 5-8.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Опишите в общих чертах процесс репликации ДНК.
2. Чем различаются ДНК и РНК?
3. Опишите сходство и различие структурных генов про- и эукариот.
4. Опишите процесс элонгации полипептидной цепи.
5. Какова наиболее вероятная нуклеотидная последовательность, кодирующая следующую аминокислотную последовательность: MAGGTWYQLFPRKMWNDSTLHPFILPMNVAG.
6. Какой аминокислотной последовательности отвечает следующая нуклеотидная последовательность: GCGAUCGACGAUGUUUCUAAAAGUAU CUCAUCGAAAUG AGGGUUCG UAAUAGCGACCCGGGCGG.
7. Что такое ТАТА-бокс?
8. Что такое оперон? В чем заключается его биологическая роль?
9. Расскажите о трех разных способах регуляции транскрипции у прокариот.
10. Опишите основные элементы ДНК, ответственные за транскрипцию эукариотических структурных генов.
ГЛАВА 4.
Технология рекомбинантных ДНК
Технология рекомбинантных ДНК (ее называют также молекулярным клонированием или генной инженерией) — это совокупность экспериментальных процедур, позволяющая осуществлять перенос генетического материала (дезоксирибонуклеиновой кислоты, ДНК) из одного организма в другой. Никакого единого, универсального набора методик здесь не существует, но чаще всего эксперименты с рекомбинантной ДНК проводят по следующей схеме (рис. 4.1).
Из организма — донора нужных генов — экстрагируют нативную ДНК (клонируемая ДНК, встраиваемая ДНК, ДНК-мишень, чужеродная ДНК), подвергают ее ферментативному гидролизу (расщепляют, разрезают) и соединяют (лигируют, сшивают) с другой ДНК (вектор для клонирования, клонирующий вектор) с образованием новой, рекомбинантной молекулы (конструкция «клонирующий вектор—встроенная ДНК»).
* Эту конструкцию вводят в клетку-хозяина (реципиент), где она реплицируется и передается потомкам. Этот процесс называется трансформацией.
• Идентифицируют и отбирают клетки, несущие рекомбинантную ДНК (трансформированные клетки).
• Получают специфический белковый продукт, синтезированный клетками-хозяевами, что служит подтверждением клонирования искомого гена.
Предпосылками к созданию технологии рекомбинантных ДНК послужили многие открытия в области молекулярной биологии, энзимологии нуклеиновых кислот и молекулярной генетики бактериальных вирусов и внехромосомных элементов бактерий (плазмид). Конструирование рекомбинантных молекул осуществляется с помощью целого арсенала ферментов — обязательного и незаменимого инструмента практически всех этапов этого сложнейшего процесса. Речь идет прежде всего о ферментах рестрикции (рестрицирующих эндонуклеазах, рестриктазах), которые узнают и расщепляют специфические нуклеотидные последовательности в двухцепочечной молекуле ДНК.
Рестрицирующие эндонуклеазы
При молекулярном клонировании важно, чтобы расщепление донорной и векторной ДНК происходило в строго определенных участках (сайтах) с образованием дискретного и воспроизводимого набора фрагментов. Если пропустить хромосомную ДНК через шприц с иглой малого диаметра или обработать ее ультразвуком, то мы получим фрагменты длиной от 0,3 до 5 т.п.н. К сожалению, в ходе этих простых операций разрывы двухцепочечных молекул происходят случайным образом, так что при каждой обработке препарата ДНК получается совершенно новый набор фрагментов. Молекулярное клонирование стало возможным только после выделения высокоспецифичных бактериальных ферментов, которые узнают определенные последовательности оснований в двухцепочечной молекуле ДНК и расщепляют обе цепи. Эти ферменты называются рестрицирующими эндонуклеазами типа II.
Одна из первых рестрицирующих эндонуклеаз типа II была выделена из бактерии Escherichia coli
Технология рекомбинантных ДНК 51
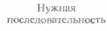 Рис. 4.1. Клонирование рекомбинантной ДНК. Донорную ДНК расщепляют рестрицирующей эндонуклеазой и встраивают в клонирующий вектор. Полученную конструкцию вводят в популяцию клеток-хозяев, идентифицируют те клетки, которые содержат рекомбинантную ДНК, и культивируют их. При необходимости можно индуцировать экспрессию клонированного гена в клетках-хозяевах и получить кодируемый белок
Рис. 4.1. Клонирование рекомбинантной ДНК. Донорную ДНК расщепляют рестрицирующей эндонуклеазой и встраивают в клонирующий вектор. Полученную конструкцию вводят в популяцию клеток-хозяев, идентифицируют те клетки, которые содержат рекомбинантную ДНК, и культивируют их. При необходимости можно индуцировать экспрессию клонированного гена в клетках-хозяевах и получить кодируемый белок
| 
|
Дата добавления: 2015-07-14; просмотров: 1122;
