ГЛАВА 3. от большинство структурных генов состоит из нескольких дискретных кодирующих областей (экзонов), разделенных некодирующими областями (интронами)
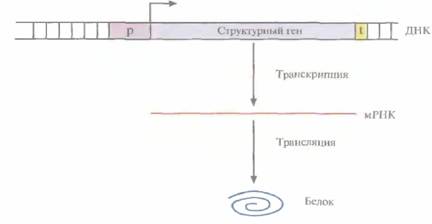
| Риc. 3.10. Схематическое изображение прокариотического структурного гена. Указаны промотор (р), сайт инициации транскрипции и ее направление (горизонтальная стрелка), область терминации транскрипции, узнаваемая РНК-полимеразой (t). Сначала на ДНК как на матрице синтезируется мРНК (транскрипция), а затем осуществляется синтез белковой цепи (трансляция). |
от большинство структурных генов состоит из нескольких дискретных кодирующих областей (экзонов), разделенных некодирующими областями (интронами). По завершении транскрипции эукариотического структурного гена интроны вырезаются из первичного продукта транскрипции с помощью ферментов, а экзоны сшиваются друг с другом «торец в торец» (сплайсинг) с образованием функциональной мРНК (рис. 3.11 и 3.12). Обычно длина экзонов составляет от 150 до 200 нуклеотидов, а длина интронов варьирует от 40 до 10 000 нуклеотидов. Очень немногие эукариотические структурные гены вообще не имеют нитронов. Иногда сплайсинг мРНК может проходить по альтернативному варианту. Например, в одной ткани функциональная мРНК может образовываться в результате соединения всех экзонов первичного транскрипта, а в другой какой-то экзон будет вырезан вместе с фланкирующими его интронами и образуется другая функциональная мРНК. Благодаря альтернативному сплайсингу в разных тканях могут образовываться разные продукты одного и того же структурного гена (рис. 3.13).
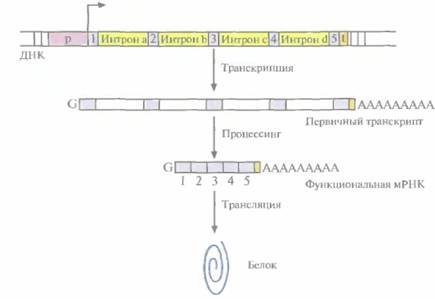
| Рис. 3.11. Схематическое изображение эукариотического структурного гена. Указаны промотор (р), сайт инициации транскрипции и ее направление (горизонтальная стрелка), область терминации транскрипции, узнаваемая РНК- полимеразой (t). 1—5 - экзоны, a— d - интроны. Первичный транскрипт содержит poly(A)-«хвост» на 3'-конце и метилированный нуклеотид G («кэп») на 5'-конце. После транскрипции интроны из первичного транскрипта вырезаются (процессинг) и на образовавшейся функциональной РНК синтезируется белковая молекула (трансляция). |
ДНК, РНК и синтез белка 37
|
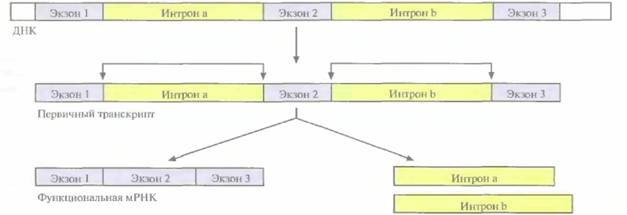
| Рис. 3.12. Сплайсинг первичного транскрипта у эукариот. Угловыми стрелками указаны места соединения экзонов 1, 2 и 3 после удаления интронов а и b, |
В активно функционирующей клетке примерно 3—5% суммарной РНК приходится на долю мРНК, 90% - на долю рРНК и 4% — на долю тРНК. мРНК может быть представлена десятками различных типов молекул, а рРНК — всего двумя типами. Более крупная рРНК образует с белками рибонуклеопротеидный комплекс, называемый большой рибосомной субъединицей, а рРНК меньшего размера комплекс, называемый малой рибосомной субъединицей. Во время синтеза белков субъединицы объединяются с образованием рибосомы. У эукариот обе рибосомные субъединицы крупнее, чем у прокариот.
Помимо тысяч рибосом, в клетке, активно синтезирующей белки, содержатся до 60 различных видов тРНК. тРНК — это линейная одноцепочечная молекула длиной от 75 до 93 нуклеотидов. В ней имеется несколько взаимнокомплементарных участков, спаривающихся между собой (рис. 3.8), а вся молекула укладывается в пространстве с образованием структуры, напоминающей букву L (рис. 3.14). С помощью специфических ферментов (аминоацил-тРНК—синтетаз) к 3'-концу тРНК
|
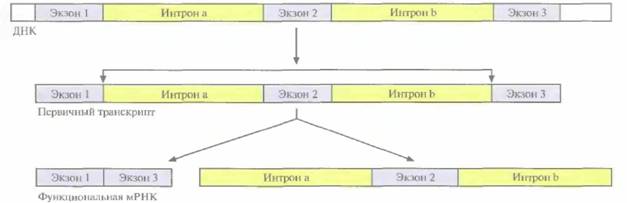
| Рис. 3.13. Альтернативный сплайсинг первичного транскрипта у эукариот. Стрелками указаны места соединения экзонов после удаления интронов. Экзон 2, фланкируемый интронами 1 и 2, вырезается из первичного транскрипта, а экзоны 1 и 3 соединяются с образованием функционально активной мРНК. |
38 ГЛАВА 3
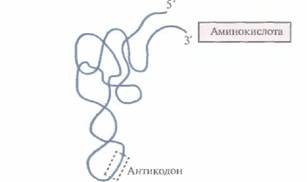
|
| Рнс.3.14. Конформация тРНК, «нагруженной» аминокислотой. Штриховой прямоугольник — антикодон. |
присоединяется соответствующая аминокислота. Так, фермент аргинил-тРНК—синтетаза присоединяет к молекуле тРНКArg аминокислоту аргинин. Для каждой из двадцати аминокислот, из которых состоят все белки, существует по крайней мере одна специфическая тРНК. На другом конце молекулы тРНК расположена последовательность из трех нуклеотидов, которая называется антикодоном. Она распознает специфический кодон в мРНК и определяет, какая именно аминокислота будет присоединена к растущей полипептидной цепи.
Трансляция
Трансляция осуществляется при участии мРНК, разных тРНК, «нагруженных» соответствующими аминокислотами, рибосом и множества белковых факторов, обеспечивающих инициацию, элонгацию и терминацию синтеза полипептидной цепи. Трансляция в прокариотических клетках инициируется формилметиониновой тРНК, которая так и называется — инициаторная тРНК. При участии белковых факторов антикодон 3'-UAC-5' инициаторной тΡΗКfMet (fMet - модифицированный метионин, аминогруппа которого формилирована) связывается с кодоном 5'-AUG-3' мРНК, образующей комплекс с малой рибосомной субъединицей. Никакая другая тРНК соединиться с этим комплексом не может. В свою очередь связывание мРНК с малой рибосомной субъединицей осуществляется посредством образования нуклеотидных пар между последовательностью примерно из восьми нуклеотидов (последовательность Шайна—Дальгарно), которая расположена вблизи 5'-конца мРНК, и комплементарной 3'-концевой последовательностью рРНК, связанной с малой рибосомной субъединицей. К комплексу fМеt-тРНКfМеt-мРНК-малая
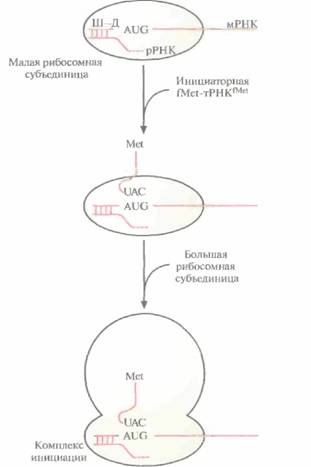
| Рис. 3.15. Инициация трансляции в прокариотической клетке. Последовательность Шайна— Дальгарно (Ш— Д), находящаяся вблизи 5'-конца мРНК, связывается с комплементарной 3'-концевой последовательностью рРНК, образующей комплекс с малой рибосомной субъединицей. Антикодон (UAC) инициаторной fMet-TPHKfMet спаривается со старт-кодоном (AUG) мРНК. К образовавшемуся комплексу присоединяется большая рибосомная субъединица, и образуется комплекс инициации. Аминогруппа метионина, связанного с инициаторной тРНК, формилирована (СНО) (на рисунке не изображено). После трансляции формилметионин отщепляется от белковой цепи. |
ДНК, РНК и синтезбелка 39
субъединица присоединяетсябольшаясубъединица,иобразуетсяинициаторныйкомплекс (комплексинициации) (рис. 3.15).
У эукариот трансляция инициируется связыванием специфической «нагруженной» инициаторной тРНК (Met-TPHKMet) и факторов инициации с малой рибосомной субъединицей. Затем мРНК присоединяется своим 5'-концом к комплексу тРНК—малая рибосомная субъединица, и комплекс продвигается по мРНК до старт-кодона (AUG). Далее антикодон UAC инициаторной Met-TPHKMet спаривается с кодоном AUG мРНК. К комплексу присоединяется большая рибосомная субъединица, и образуется инициаторный комплекс (рис. 3.16.)
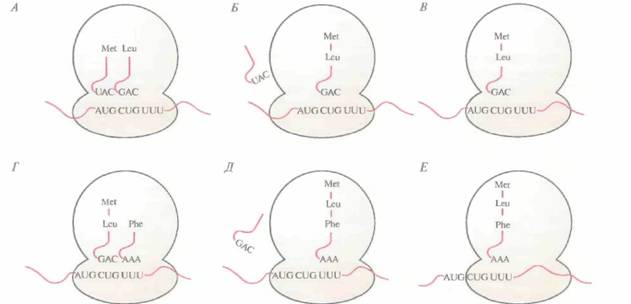
Этапы элонгации и терминации у про- и эукариот во многом сходны. Процесс элонгации включает образование пептидных связей между соседними аминокислотами, при этом очередность присоединяемых аминокислот определяется очередностью кодонов в мРНК (рис. 3.17). Рассмотрим процесс более подробно. После образования инициаторного комплекса кодон в молекуле мРНК, следующий за кодоном AUG, спаривается с комплементарным ему антикодоном соответствующей тРНК, определяя таким образом, какая из нагруженных тРН К присоединится к рибосоме (ненагруженные тРНК не связываются с рибосомами). Если вторым триплетом в мРНК оказывается CUG, то следующей к рибосомному комплексу присоединяется несущая лейцин тРНК с антикодоном 3'-GAC-5'. Когда эта тРНК оказывается на месте, между карбоксильной группой метионина и аминогруппой лейцина с помощью ферментативной активности, присущей большой субъединице, образуется пептидная связь, при этом лейцин остается связанным со своей тРНК, а метионин отсоединяется от инициаторной тРНК, и последняя отделяется от рибосомы. Комплекс метионин—лейцин— тРНКLeu—мРНК «протягивается» через рибосому (транслокация), так что следующий кодон мРНК может связаться с нагруженной тРНК, несущей соответствующий антикодон. Если третьим кодоном мРНК является UUU, то следующей аминокислотой в растущей полипептидной цепи будет фенилаланин; его доставит к рибосоме тРНК с антикодоном ААА. Когда эта тРНК окажется на месте, между карбоксильной группой лейцина и аминогруппой фенилаланина образуется пептидная связь. тРНКLeu отделится от рибосомы, произойдет транслокация пептидил-тРНКPhe (тРНК с присоединенной к ней растущей полипептидной цепью), и следующий кодон мРНК сможет связаться с антикодоном соответствующей нагруженной тРН К.
Эти события — связывание нагруженной тРНК с мРНК благодаря комплементарному спарива-
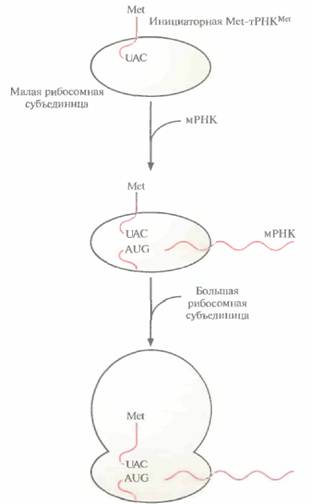
| Рнс. 3.16. Инициация трансляции в эукариотической клетке. Малая рибосомная субъединица связывается с инициаторной тРНК, «нагруженной» метионином (Меt-тРНКМеt), комплекс продвигается по мРНК, пока антикодон U АС инициаторной тРНК не спарится со старт-кодоном AUG мРНК. Далее к комплексу мРНК— тРНК— малая субъединица присоединяется большая субъединица и образуется комплекс инициации. |
40 ГЛАВА 3
|
| Рис, 3.17. Элонгация полипептидной цепи, А. Второй кодон (CUG) в мРНК связываете с антикодоном (GAC) Leu-тРНКLeu. Б. Метионин образует пептидную связь с лейцином, доставленным тРНКLeu, освободившаяся от аминокислоты инициаторная тРНК отсоединяется. А Транслокация комплекса пептидил-тРНК--мРНК с экспонированием следующего кодона (UUU). Г. Третий кодон (UUU) спаривается с антикодоном ААА Рhе-тРНКPhe. Д. Лейцин образует пептидную связь с фенилаланином, доставленным тРНКPhe, освободившаяся от аминокислоты тРНКLeu отсоединяется от рибосомы. Е. Транслокация комплекса пептидил-тРНК-мРНК с экспонированием следующего кодона, и т, д. |
нию кодона с антикодоном, образование пептидной связи, отсоединение «разгруженной» тРНК, транслокация — продолжаются до тех пор, пока не соединятся друг с другом все аминокислоты, закодированные в мРНК. Трансляция происходит в направлении 5'—3' со скоростью примерно 15 аминокислот в секунду. Когда 5'-конец мРНК высвобождается из рибосомного комплекса, он может связаться с другим таким же комплексом, так что одна молекула мРНК может одновременно транслироваться множеством рибосом.
Элонгация продолжается до тех пор, пока рибосома не дойдет до кодона UAA, UAG или UGA (стоп-кодон, терминирующий кодон) (рис. 3.18). В норме в клетках отсутствуют тРНК с антикодонами, комплементарными сигналам терминации. Их узнают белковые факторы освобождения (терминации). При связывании фактора освобождения с рибосомой происходит гидролиз связи между последней тРНК и полипептидом, свободная тРНК, полипептидная цепь и мРНК отсоединяются от рибосомы. Рибосома диссоциирует на субъединицы, которые могут вновь участвовать в трансляции.
После трансляции многие полипептиды подвергаются различным модификациям. У большинства из них отщепляется N-концевой метионин, так что N-концевым остатком становится вторая аминокислота. У эукариот происходит так называемый процессинг некоторых белков, когда полипептидная цепь расщепляется в определенных сайтах с образованием более коротких белковых молекул со специфическими функциями. В некоторых случаях, особенно в эукариотических клетках, к определенным аминокислотам ферментативным путем присоединяются фосфатные группы, липиды, углеводы или другие низкомолекулярные соединения. В результате этих химических модификаций образуются белки, выполняющие в клетке специфические функции.
Генетический словарь состоит из 64 кодонов. Три из них — это стоп-кодоны, а один (AUG) -старт-кодон (табл. 3.2), кодирующий еще и аминокислоту метионин. Когда кодон AUG находится не на 5'-конце молекулы мРНК, а в ее внутренней области, то он распознается другой тРНК (Met-TPHKMet), к которой присоединен немоди-
ДНК, РНК и синтез белка 41
| Таблица 3.2. Генетический код и частота использования разных кодонов в геноме E. coli и человека | |||||||
| Кодон | Аминокислота | Частота использования | Кодон | Аминокислота | Частота использования | ||
| Е. coli | человек | Е. coli | человек | ||||
| GGG | Глицин | 0,13 | 0,23 | UAG | Стоп | 0,09 | 0,17 |
| GGA | Глицин | 0,09 | 0 26 | UAA | Стоп | 0,62 | 0,22 |
| GGU | Глицин | 0,38 | 0,18 | UAU | Тирозин | 0,53 | 0,42 |
| GGC | Глицин | 0,40 | 0.33 | UAC | Тирозин | 0,47 | 0,58 |
| GAG | Глутаминовая кислота | 0,30 | 0,59 | UUU | Фенилаланин | 0,51 | 0,43 |
| GAA | Глутаминовая кислота | 0,70 | 0,41 | UUC | Фенилаланин | 0,49 | 0.57 |
| GAU | Аспарагиновая кислота | 0,59 | 0,44 | UCG | Серин | 0,13 | 0,06 |
| GAC | Аспарагиновая кислота | 0,41 | 0,56 | UCA | Серин | 0,12 | 0,15 |
| GUG | Валин | 0,34 | 0,48 | UCU | Серин | 0,19 | 0,17 |
| GUА | Валин | 0,17 | 0,10 | UCC | Серин | 0,17 | 0,23 |
| GUU | Валин | 0,29 | 0,17 | AGU | Серин | 0,13 | 0,14 |
| GUC | Валин | 0,20 | 0,25 | AGC | Серин | 0,27 | 0,25 |
| GCG | Аланин | 0,34 | 0.10 | CGG | Аргинин | 0,08 | 0.19 |
| GCA | Аланин | 0,22 | 0,22 | CGA | Аргинин | 0,05 | 0,10 |
| GCU | Аланин | 0,19 | 0,28 | CGU | Аргинин | 0,42 | 0,09 |
| GCC | Аланин | 0,25 | 0,40 | CGC | Аргинин | 0,37 | 0,19 |
| AAG | Лизин | 0 74 | 0,60 | AGG | Аргинин | 0,03 | 0,22 |
| AAA | Лизин | 0 ,76 | 0,40 | AGA | Аргинин | 0,04 | 0,21 |
| AAU | Аспарагин | 0,39 | 0,44 | СAG | Глутамин | 0,69 | 0,73 |
| AAC | Аспарагин | 0,61 | 0,56 | CAA | Глутамин | 0,31 | 0,27 |
| AUG | Метионин, старт | 1,00 | 1,00 | CAU | Гистидин | 0,52 | 0,41 |
| AUA | Изолейцин | 0 ,07 | 0,14 | CAC | Гистидин | 0,48 | 0,59 |
| AU U | Изолейцин | 0,47 | 0,35 | CUG | Лейцин | 0,55 | 0,43 |
| AUC | Изолейцин | 0,46 | 0,51 | CUA | Лейцнн | 0,03 | 0,07 |
| АСG | Треонин | 0,23 | 0,12 | CUU | Лейцин | 0,10 | 0,12 |
| АСА | Треонин | 0,12 | 0,27 | CUC | Лейцин | 0,10 | 0,20 |
| ACU | Треонин | 0,21 | 0,23 | UUG | Лейцин | 0,11 | 0,12 |
| ACC | Треонин | 0,43 | 0,38 | UUA | Лейцин | 0,11 | 0,06 |
| UGG | Триптофан | 1,00 | 1,00 | CCG | Πролин | 0,55 | 0,11 |
| UGU | Цистеин | 0,43 | 0,42 | CCA | Пролин | 0,20 | 0,27 |
| UGC | Цистеин | 0,57 | 0,58 | CCU | Пролин | 0,16 | 0,29 |
| UGA | Стоп | 0,30 | 0,61 | CCC | Пролин | 0,10 | 0,33 |
фицированный метионин. Аминокислота триптофан кодируется всего одним кодоном (UGG), остальные аминокислоты, из которых состоят белки, — по крайней мере двумя, чаще четырьмя, а иногда и шестью кодонами. Например, для лейцина существует шесть кодонов: (UUA, UUG, CUU, CUC, CUA и CUG. Синонимичные кодоны используются различными организмами с разной частотой. Из четырех кодонов для глицина GGA используется в структурных генах человека в 26% случаев, а в Escherichia coli — в 9%. Такая же ситуация наблюдается и для стоп-кодонов. Так, у человека частота использования кодонов UAA, UAG и UGA составляет 0,22, 0,17 и 0,61 соответственно, а у E. coli — 0,62,0,09 и 0,30. Несмотря на все эти различия, генетический код у всех организмов, за редким исключением, одинаков.
Регуляция транскрипции у бактерий
Все процессы, протекающие в бактериальной клетке, — образование аминокислот, нуклеотидов и других важных метаболитов, репликация, транскрипция, трансляция, катаболизм, высвобождение энергии, реакции на внешние воздействия — требуют участия белков. Однако энергетических ресурсов клетки не хватает для одновременного осуществления транскрипции и трансляции (экспрессии) всех структурных генов. Поэтому постоянно экспрессируются толь-
42 ГЛАВА 3
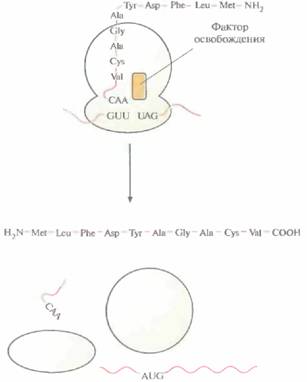
| Рис. 3.18. Терминация трансляции. Со стоп-кодоном (UAG) связывается фактор освобождения, и трансляция завершается. Химическая связь между последней тРНК и полипептидной цепью разрывается, свободная тРНК, мРНК и готовая белковая цепь отсоединяются от рибосомы, и последняя диссоциирует на субъединицы. |
ко те гены, которые кодируют белки, поддерживающие основные клеточные функции, а транскрипция остальных структурных генов регулируется. Когда у клетки возникает потребность в каком-то белке (белках), то инициируется (включается) транскрипция соответствующего структурного гена (генов), а когда такая потребность исчезает, транскрипция выключается.
Часто у бактерий белки одного метаболического пути кодируются смежными структурными генами. Нуклеотидная последовательность, в которой закодировано более одного белка, называется опероном. Обычно оперон находится под контролем единственного промотора, и при его транскрипции образуется одна длинная молекула мРНК, кодирующая несколько белков. При трансляции такой мРНК, в которой стоп-кодон последовательности, кодирующей один белок, соседствует со старт-кодоном гена следующего белка, синтезируется набор дискретных белков.
В большинстве структурных генов Е. coli имеются два сайта связывания для РНК-полимеразы. Один из них обычно представляет собой нуклеотидную последовательность
ТАТААТ
АТАТТА (ТАТА-бокс, или бокс Прибнова), а другой -
TTGAC
AACTG.
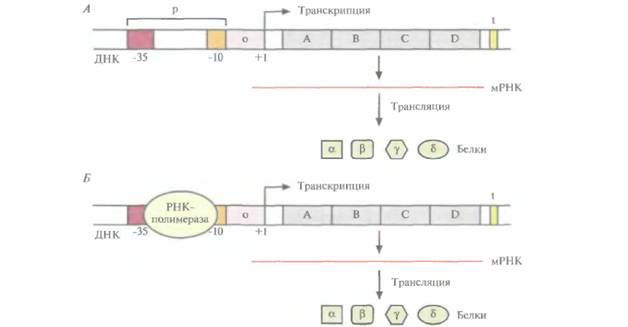
ТАТА-бокс и последовательность TTGAC расположены за 10 (область —10) и 35 (область —35) нуклеотидов до сайта инициации транскрипции соответственно (нуклеотид +1) (рис. 3.19). Обычно от участка между ТАТА-боксом и нуклеотидом +1 во многом зависит, будет ли происходить транскрипция данного оперона. В зависимости от способа регуляции транскрипции оперона этот участок называется оператором или активатором.
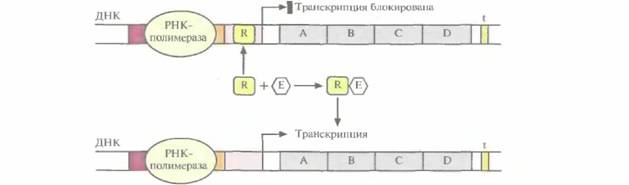
Для включения и выключения разных оперонов в ходе эволюции сформировалось множество регуляторных систем. Например, с операторной областью может быть связан регуляторный белок, называемый репрессором; он мешает перемещению РНК-полимеразы вдоль молекулы ДНК, и транскрипция блокируется (рис. 3.20). Однако если с репрессором свяжется некое низкомолекулярное вещество (эффектор), то его конформация изменится таким образом, что его связывание с операторной областью станет невозможным, и транскрипция возобновится. Обычно эффектор разрушается клеточными ферментами. Когда его концентрация снижается, репрессор связывается с операторным участком, и транскрипция вновь прекращается. Операторный участок специфичен для каждого оперона, а эффектор взаимодействует только с определенным репрессором.
В качестве иллюстрации рассмотрим такой пример. Предположим, что клетка способна метаболизировать определенный сахар. Тогда синтез ферментов, расщепляющих этот сахар, будет бесполезной тратой клеточных ресурсов, если он отсутствует в среде. С другой стороны, если этот сахар имеется в достаточном количестве и является единственным источником углерода, то ферменты, отвечающие за его утилизацию
ДНК, РНК и синтез белка 43
|
| Рис. 3.19. Транскрипция в бактериальной клетке. А, Структурные гены (А, В, С и D) оперона находятся под транскрипционным контролем оператора (о) и промотора (р). РНК-полимераза связывается с участками, находящимися на расстоянии 10 (-10) и 35 (-35) пар оснований от сайта инициации транскрипции (+1). t- Стоп-сигнал, ответственный за остановку транскрипции, α, β, γ и S - белки, продукты генов А, В, С, D. Б. То же, что и на рис. А, но показано связывание РНК-полимеразы с промоторной областью. |
клеткой, становятся совершенно необходимыми. В этом случае сахар действует как эффектор, препятствуя связыванию репрессора с операторным участком и таким образом обеспечивая транскрипцию оперона и синтез ферментов.
При истощении запасов сахара в среде репрессор связывается с операторным участком, и транскрипция оперона прекращается.
Нормальным состоянием других оперонов может быть состояние, при котором осуществ-
|
| Рис. 3.20. Включение транскрипции бактериального оперона. Репрессор (R) связывается с оператором и блокирует транскрипцию. Связывание эффектора (Е) с репрессором изменяет его конформацию, и он не может связаться с оператором. РНК-полимераза беспрепятственно перемещается вдоль молекулы ДНК, осуществляя транскрипцию. |
Дата добавления: 2015-07-14; просмотров: 1477;
