ДИСТИЛЛЯЦИЯ И РЕКТИФИКАЦИЯ
Дистилляция (перегонка) и ректификация получили широкое распространение во многих отраслях промышленности для разделения однородных жидких смесей с различной температурой кипения образующих их жидкостей.
Дистилляцией называется процесс частичного испарения разделяемой смеси жидкостей и последующей конденсации образующихся паров, осуществляемой однократно или многократно. Составы жидкой и паровой фаз, образующихся при этом, заметно различаются, однако с помощью дистилляции нельзя получить компоненты исходного раствора в практически чистом виде.
Получение практически чистых компонентов может быть осуществлено с помощью ректификации – разделения однородных жидких смесей, не находящихся в термодинамическом равновесии, на составляющие вещества или группы составляющих веществ в результате противоточного взаимодействия паровой и жидких фаз.
Состав паров в процессах дистилляции и ректификации определяется различной летучестью компонентов при одной и той же температуре. Исходя из этого различают низкокипящие (легколетучие) и высококипящие (труднолетучие) компоненты. Низкокипящий компонент имеет наибольшее давление паров при данной температуре по сравнению с давлением паров любого другого компонента смеси и соответственно наименьшую температуру кипения при одинаковом для всех компонентов давлении. Компонент, обладающий наименьшим давлением или наивысшей температурой кипения, называется высококипящим компонентом.
Согласно правилу фаз Гиббса (В. 4), учитывая то, что число компонентов, участвующих в массообменном процессе, равно двум, фаз также две (жидкость и пар), число степеней свободы равно двум.
В соответствии с законом Рауля (10.4)
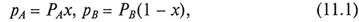
где рA, рB – парциальные давления компонентов А и В; х, (1 - х) –мольные доли компонентов А и В в исходной смеси; РА, РB – давления паров чистых компонентов А и В.
В то же время, парциальные давления компонентов в системе по закону Дальтона (10.3)
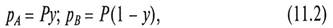
где Р – общее давление в системе; у, (1 - у) – мольные доли компонентов А и В в паровой смеси.
Для установившегося равновесия из уравнений (11.1), (11.2)
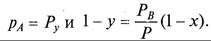
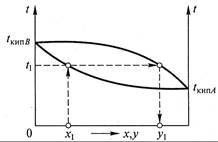
Поскольку процессы в аппаратах осуществляются практически всегда при изобарических условиях (Р= const), равновесную зависимость рассматриваемого процесса можно представить как функции двух переменных (по количеству степеней свободы) t – x, t – у и у – х. При этом графики t – у и t – x можно совместить (рис. 11.1).
Нижняя ветвь на диаграмме (см. рис. 11.1) отвечает температурам кипения жидкой смеси, верхняя – температурам конденсации паровой смеси. tкип А и tкип B – температуры кипения чистых компонентов А и В соответственно.
Используя диаграмму (см. рис. 11.1), можно по составу жидкой фазы х1 найти равновесный ей состав пара у1 и температуру в системе t1.
Для идеальных смесей в соответствии с законами Рауля (11.1 и Дальтона (11.2) можно записать
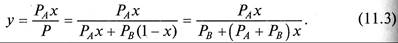
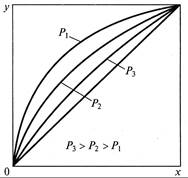
Введя величину относительной летучести компонента А по от ношению к компоненту В
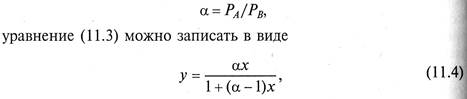
графическая зависимость которого для разных давлений в системе представлена на рис. 11.2.
|


|

где α1 и α2 – относительные летучести компонентов А и В при tкип А и
tкип В.
В то же время следует учитывать, что равновесие в рассматриваемой смеси зависит от давления в системе (см. рис. 11.2).
Кроме идеальных систем существуют реальные, к которым, например, относятся смеси компонентов А и В, полностью нерастворимых друг в друге. В этом случае силы взаимодействия молекул этих компонентов равны нулю, а каждый из них ведет себя независимо друг от друга. Рассматриваемая смесь закипает при давлении
Р = РА + PВ.
При этом парциальное давление каждого компонента равно давлению насыщенного пара при той же температуре. Температура кипения смеси tcм остается постоянной независимо от состава жидкой смеси (линии abd на рис. 11.3, а).
Так как в природе нет абсолютно нерастворимых друг в друге веществ, в интервалах незначительной растворимости одного компонента в другом температура кипения по линиям ас или dе будет
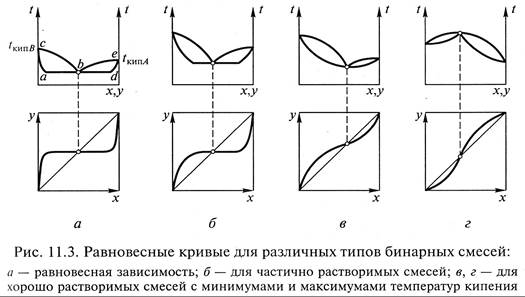
меняться до температуры кипения основного компонента смеси.
В областях растворимости будет плавное изменение температур конденсации пара по линиям сb и eb. В точке b будет конденсироваться пар состава уb, причем значение этой величины равно
уb = PA/P = const.
На основе представленной диаграммы t – х, у можно построить равновесную зависимость в координатах y – x (см. рис. 11.3, а).
Если рассмотреть поведение частично растворимых смесей, то для этих систем зона между линиями постоянных температур уже (рис. 11.3, б).
Для неидеальных хорошо растворимых смесей характерны зависимости с явно выраженными минимумами (рис. 11.3, в) или максимумами (рис. 11.3, г) температур кипения смеси.
На приведенных диаграммах имеются точки пересечения равновесной линии с диагональю, в которых состав пара равен составу жидкости. Это так называемые точки азеотропных составов, в которых системы находятся в термодинамическом равновесии, и разделение их методами дистилляции и ректификации невозможно.
Дата добавления: 2015-08-14; просмотров: 2097;