Свойства растворов
1. Концентрацией х, или составом раствора, называется массовое количество растворенного твердого вещества Gтв в определенном массовом или объемном количестве раствора или растворителя W, которое определяется в процентах как
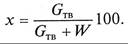
Для большинства растворов в определенном количестве растворителя при конкретных условиях можно растворить ограниченное количество твердого вещества. Раствор, содержащий при данных условиях предельное количество растворенного вещества, называется насыщенным. Количество растворенного вещества в насыщенном растворе, отнесенное к определенному количеству раствора или растворителя, называется растворимостью. Растворимость твердых веществ в воде не является постоянной величиной, а изменяется в значительных пределах в зависимости от температуры. При этом различают вещества с прямой растворимостью, которая увеличивается с повышением температуры (NaNO3, KNO3, NаОН, КОН и др.), и обратной растворимостью, падающей с повышением температуры (MnSO4, Na2SO4 и др.).
2. Теплоемкость с веществ, и в частности растворов, незначительно зависит от температуры. Однако концентрация растворенного вещества оказывает значительное влияние на величину теплоемкости. Функция эта имеет нелинейную зависимость, поэтому для проведения расчетов обычно пользуются справочными данными, представленными в виде таблиц или графиков.
3. Температурная депрессия Δт.д. Температура кипения воды при нормальном давлении составляет 100°С. Ту же температуру имеют образовавшиеся водяные пары. Температура кипения воды понижается с уменьшением окружающего давления и повышается с его увеличением. На ту же величину изменяется температура паров над чистой жидкостью.
Если в кипящей жидкости находится растворенное вещество, то раствор начинает кипеть при более высокой температуре, увеличивающейся c повышением концентрации растворенного вещества. Температура образующихся при этом паров над раствором будет меньше, и ее величина соответствует температуре кипения чистого растворителя при том же давлении.
Разность между температурой кипения раствора tкип.р и растворителя tкип называют физико-химической или температурной депрессией

и определяют по таблицам и графикам, составленным на основании опытных данных.
4. Теплота растворения (концентрирования). При проведении процесса растворения солей происходят физико-химические процессы, сопровождающиеся противоположными тепловыми эффектами.
Так, разрушение кристаллической решетки твердого вещества требует затрат энергии и сопровождается поглощением теплоты. Химическое взаимодействие растворяемого вещества с растворителем – сольватация (при растворении в воде – гидратация) сопровождается выделением теплоты. Алгебраическая сумма выделившейся и поглощенной теплоты определяет общий тепловой эффект процесса растворения. Эта же величина с обратным знаком характеризует тепловой эффект в процессе концентрирования Δq и может быть определена из справочной литературы для конкретных условий проведения процесса.
Дата добавления: 2015-08-14; просмотров: 1430;
