Уравнение Ван-дер-Ваальса
Уравнения состояния газа. Идеальный газ, реальный газ. Формы (виды) уравнений состояния для газов. Уравнение Нобля-Абеля (Дюпре), как следствие уравнения Ван-дер-Ваальса.
УРАВНЕНИЯ СОСТОЯНИЯ ГАЗА F(p, r ,T):
Частные случаи: F(r ,T) F(p, r) F(p, T).
Конкретная запись зависит от модели представления газа:
Идеальный газ
Реальный газ
Идеальный газ
1) Объемом, занимаемым молекулами, пренебрегается
2) Силами взаимодействия между молекулами пренебрегается
Связь между давлением, плотностью и температурой описывается уравнением Клапейрона-Менделеева: pW=wRT или p= rRT (1)
где p – давление; W – объем; R=nr; n =1000/M - число молей газа в 1 кг пороха; М=23-25 г/моль; r=8,3143 КДж/(кг.град) – универсальная газовая постоянная; Т – температура газа.
Формула (1) применяется для давлений до 50 МПа.
Реальный газ
1) Объем, занимаемый молекулами, учитывается
2) Силы взаимодействия между молекулами учитываются
Связь между давлением, плотностью и температурой описывается уравнениями Ван-дер-Ваальса, Нобля-Абеля (Дюпре) и вириальным.
Уравнение Ван-дер-Ваальса
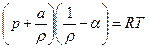 (2)
(2)
где a – коэффициент, учитывающий сцепление между молекулами; a – коволюм газов (дм3/кг), параметр, равный учетверенному собственному объему молекул.
Формула (1) применяется при давлениях в десятки тысяч МПа.
Дата добавления: 2015-07-06; просмотров: 851;
