Расчет материального баланса реакции.
i – компонент;
j – реакция;
ni – количество вещества в периодических реакторах.
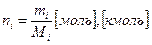
Если процессы непрерывные, то используют мольный поток:
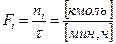
Реакция в общем виде:
υАА + υВВ → υYY + υZZ
Уравнение материального баланса в общем виде.
| A | B | Y | Z | |
| Начало реакции τ = τ0 | nA0 | nB0 | nY0 | nZ0 |
| Текущее время τ = τр | nA | nB | nY | nZ |
| Израсходовано/ образовалось | nA0 - nA = -(nA - nA0) | nB0 - nB = -(nB - nB0) | nY – nY0 | nZ – nZ0 |
| Стехиометрический коэффициент υi | υA | υB | υY | υZ |
Существует правило, что υA и υB имеет отрицательные знаки (идет расход), а υY и υZ – положительные.
|υi| – ?
|υA| = – υA
|υY| = υY
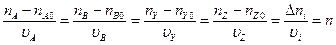
Материальная запись закона, что вещества вступают в реакцию в соответствии с их стехиометрическими коэффициентами.
n – полнота протекания реакции. Она всегда положительная и инвариантна относительно участников реакции.
Для непрерывных процессов:
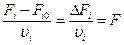 – полнота протекания реакции.
– полнота протекания реакции.
По этим уравнениям, зная хотя бы для одного вещества Fi, Fi0 и рассчитав полноту протекания реакции, может определить текущие концентрации других веществ, зная из начальное количество.
|
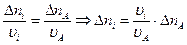 – уравнение прямой
– уравнение прямой
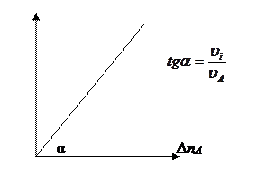
Обозначения:
А – реагент, который является дорогостоящим или определяющим основную схему реакции.
В – целевой продукт.
Когда анализируется сложная реакция, то необходимо определить количество стехиометрически независимых превращений – R.
Стехиометрически независимая реакция:
C2H5OH 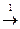 C2H4 + H2O
C2H4 + H2O
2 C2H5OH 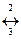 (C2H5)2O + H2O
(C2H5)2O + H2O
(C2H5)2O 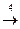 C2H4 + C2H5OH
C2H4 + C2H5OH
При определении стехиометрически независимых реакций необходимо отбросить те реакции, которые получаются в результате комбинации, то есть сложения, вычитания, умножения или деления стехиометрических множителей (коэффициентов других реакций).
Третья реакция не является независимой, так как её можно получить умножением стехиометрических коэффициентов на -1 из второй реакции.
Если вычесть из первой реакции вторую, что получим:
C2H5OH - 2 C2H5OH → C2H4 + H2O - (C2H5)2O - H2O
- C2H5OH → C2H4 - (C2H5)2O
(C2H5)2O → C2H4 + C2H5OH
То есть, для данной реакции R = 2.
Правило: если в реакции получилось новое вещество, то оно должно быть стехиометрически независимой.
| Реакция | ||||
| C2H5OH | -1 | -2 | ||
| C2H4 | ||||
| (C2H5)2O | -1 | -1 | ||
| H2O | -1 |
Таблица – матрица. Нахождение ранга матрицы – математическая задача. Ранг матрицы равен R.
После расчета R и числа независимых реакций, необходимо найти ключевые вещества.
Ключевое вещество должно удовлетворять требованиям:
1. В каждой независимой реакции должно участвовать хотя бы одно ключевое вещество. В тоже время ключевое вещество, желательно, должно участвовать в одном или минимальном количестве уравнений.
2. Ключевые вещества должны легко определяться экспериментально.
3. Ключевое вещество должно участвовать только в одной реакции или в минимальном числе реакций.
4. Должно легко аналитически определяться.
Уравнение молярного баланса:
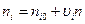
Для непрерывного процесса:
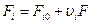
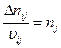 и
и 
По всем реакциям:
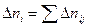
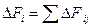
В итоге получаем:
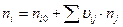
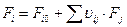
Дата добавления: 2015-08-14; просмотров: 2946;
