Свойства водяного пара
В качестве реального газа рассмотрим водяной пар, который широко используется во многих отраслях техники, и, прежде всего в теплоэнергетике, где он является основным рабочим телом. Поэтому исследование термодинамических свойств воды и водяного пара имеет большое практическое значение.
Во всех областях промышленного производства получили большое применение пары различных веществ: воды, аммиака, углекислоты и др. Из них наибольшее распространение получил водяной пар, являющийся рабочим телом в паровых турбинах, паровых машинах, в атомных установках, теплоносителем в различных теплообменниках и т. п.
Процесс превращения вещества из жидкого состояния в газообразное называется парообразованием. Испарением называется парообразование, которое происходит всегда при любой температуре со свободной поверхности жидкости или твердого тела. Процесс испарения заключается в том, что отдельные молекулы с большими скоростями преодолевают притяжение соседних молекул и вылетают в окружающее пространство. Интенсивность испарения возрастает с увеличением температуры жидкости.
Процесс кипения заключается в том, что если к жидкости подводить теплоту, то при некоторой температуре, зависящей от физических свойств рабочего тела и давления, наступает процесс парообразования как на свободной поверхности жидкости, так и внутри её.
Переход вещества из газообразного состояния в жидкое или твердое называется конденсацией. Процесс конденсации, так же как и процесс парообразования, протекает при постоянной температуре, если при этом давление не меняется. Жидкость, полученную при конденсации пара, называют конденсатом.
Процесс перехода твердого вещества непосредственно в пар называется сублимацией. Обратный процесс перехода пара в твердое состояние называется десублимацией.
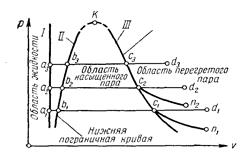
Процесс парообразования. Основные понятия и определения.Рассмотрим процесс получения пара. Для этого 1 кг воды при температуре О °С поместим в цилиндр с подвижным поршнем. Приложим к поршню извне некоторую постоянную силу Р. Тогда при площади поршня Fдавление будет постоянным и равным р = Р/F. Изобразим процесс парообразования, т. е. превращения вещества из жидкого состояния в газообразное, в р,v диаграмме (рис.14).

|

|

|
|
| Рис. 14. Процесс парообразования в pv-диаграмме |
Начальное состояние воды, находящейся под давлением ри имеющей температуру 0 °С, изобразится на диаграмме точками a1, a2, a3. При подводе теплоты к воде ее температура постепенно повышается до тех пор, пока не достигнет температуры кипения ts, соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t = 4°С, а затем начинает возрастать. (Такой аномалией — увеличением плотности при нагревании в некотором диапазоне температур — обладают немногие жидкости). У большинства жидкостей удельный объем при нагревании увеличивается монотонно.) Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точками b1, b2, b3.
При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объема. В цилиндре теперь находится двухфазная среда — смесь воды и пара, называемая влажным насыщенным паром. Насыщенным называется пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется. Динамическое равновесие заключается в том, что количество молекул, вылетающих из воды в паровое пространство, равно количеству молекул, конденсирующихся на ее поверхности. В паровом пространстве при этом равновесном состоянии находится максимально возможное при данной температуре число молекул. При увеличении температуры количество молекул, обладающих энергией, достаточной для вылета в паровое пространство, увеличивается. Равновесие восстанавливается за счет возрастания давления пара, которое ведет к увеличению его плотности и, следовательно, количества молекул, в единицу времени конденсирующихся на поверхности воды. Отсюда следует, что давление насыщенного пара является монотонно возрастающей функцией его температуры, или, что то же самое, температура насыщенного пара есть монотонно возрастающая функция его давления.
При увеличении объема над поверхностью жидкости, имеющей температуру насыщения, некоторое количество жидкости переходит в пар, при уменьшении объема «излишний» пар снова переходит в жидкость, но в обоих случаях давление пара остается постоянным.
Если парообразование жидкости происходит в неограниченном пространстве, то вся она может превратиться в пар. Если же парообразование жидкости происходит в закрытом сосуде, то вылетающие из жидкости молекулы заполняют свободное пространство над ней, при этом часть молекул, движущихся в паровом пространстве над поверхностью, возвращается обратно в жидкость. В некоторый момент между парообразованием и обратным переходом молекул из пара в жидкость может наступить равенство, при котором число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся обратно в жидкость. В этот момент в пространстве над жидкостью будет находиться максимально возможное количество молекул. Пар в этом состоянии принимает максимальную плотность при данной температуре и называется насыщенным.
Таким образом, пар, соприкасающийся с жидкостью и находящийся в термическом с ней равновесии, называется насыщенным. С изменением температуры жидкости равновесие нарушается, вызывая соответствующее изменение плотности и давления насыщенного пара.
Двухфазная смесь, представляющая собой пар с взвешенными в нем капельками жидкости, называется влажным насыщенным паром. Таким образом, влажный насыщенный водяной пар можно рассматривать как смесь сухого насыщенного пара с мельчайшими капельками воды, взвешенными в его массе.
Массовая доля сухого насыщенного пара во влажном называется степенью сухости пара и обозначается буквой х. Массовая доля кипящей воды во влажном паре, равная 1—х, называется степенью влажности. Для кипящей жидкости x = 0, а для сухого насыщенного пара х= 1. Состояние влажного пара характеризуется двумя параметрами: давлением (или температурой насыщения ts, определяющей это давление) и степенью сухости пара.
По мере подвода теплоты количество жидкой фазы уменьшается, а паровой — растет. Температура смеси при этом остается неизменной и равной ts,так как вся теплота расходуется на испарение жидкой фазы. Следовательно, процесс парообразования на этой стадии является изобарно-изотермическим. Наконец, последняя капля воды превращается в пар, и цилиндр оказывается заполненным только паром, который называется сухим насыщенным.
Насыщенный пар, в котором отсутствуют взвешенные частицы жидкой фазы, называется сухим насыщенным паром. Его удельный объем, и температура являются функциями давления. Поэтому состояние сухого пара можно задать любым из параметров — давлением, удельным объемом или температурой.
Состояние его изображается точками c1, с2, с3.
Точками изображается перегретый пар. При сообщении сухому пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться. Точка d (d1, d2, d3) изображает состояние перегретого пара и в зависимости от температуры пара может лежать на разных расстояниях от точки c.
Таким образом, перегретым называется пар, температура которого превышает температуру насыщенного пара того же давления.
Так как удельный объем перегретого пара при том же давлении больше, чем насыщенного, то в единице объема перегретого пара содержится меньшее количество молекул, значит, он обладает меньшей плотностью. Состояние перегретого пара, как и любого газа, определяется двумя любыми независимыми параметрами.
Процесс получения сухого насыщенного пара при постоянном давлении изображается в общем случае графиком abc, а перегретого пара в общем случае — графиком abсd, при этом ab — процесс подогрева воды до температуры кипения, bс — процесс парообразования, протекающий одновременно при постоянном давлении и при постоянной температуре, т. е. процесс bс является изобарным и одновременно изотермическим и, наконец, cd — процесс перегрева пара при постоянном давлении, но при возрастающей температуре. Между точками b и с находится влажный пар с различными промежуточными значениями степени сухости.
Кривая I холодной воды изображается линией, параллельной оси ординат, если исходить из предположения, что вода несжимаема и, следовательно, удельный объем воды почти не зависит от давления. Кривую II называют нижней пограничной кривой, или кривой жидкости, а кривую III — верхней пограничной кривой, или кривой сухого насыщенного пара. Кривая II отделяет на диаграмме область жидкости от области насыщенных паров, а кривая III — область насыщенных от области перегретых паров.
Точки а1, а2 и а3, изображающие состояние 1 кг холодной воды при температуре 0°С и разных давлениях, располагаются практически на одной вертикали. Точки b1, b2 и b3 с увеличением давления смещаются вправо, так как при этом соответственно увеличиваются также температуры кипения tH и, следовательно, удельные объемы кипящей воды. Точки c1, с2 и с3 смещаются влево, так с увеличением давления удельный объем пара уменьшается несмотря на возрастание температуры.
Из pv -диаграммы видно, что с повышением давления точки b1, b2 и b3 и c1 с2 и с3 сближаются, т. е. постепенно уменьшается разность удельных объемов сухого насыщенного пара и кипящей воды (отрезки bc). Наконец, при некотором давлении эта разность становится равной нулю, т. е. точки б и с совпадают, а линии II и III сходятся. Точка встречи обеих кривых называется критической точкой и обозначается буквой k. Состояние, соответствующее точке k, называется критическим состоянием.
Параметры водяного пара критического состояния следующие: давление рк = 225,65 ата; температура t = 374,15° С, удельный объем vK = 0,00326 м3/кг.
В критической точке кипящая вода и пар имеют одинаковые параметры состояния, а изменение агрегатного состояния не сопровождается изменением объема. Иными словами, в критическом состоянии исчезает условная граница, разделяющая эти две фазы вещества. При температурах, выше критической (t > tK), никаким повышением давления перегретый пар (газ) не может быть обращен в жидкость.
Критическая температура — это максимально возможная температура сосуществования двух фаз: жидкости и насыщенного пара. При температурах, больших критической, возможно существование только одной фазы. Название этой фазы (жидкость или перегретый пар) в какой-то степени условно и определяется обычно ее температурой. Все газы являются сильно перегретыми сверх Tкр парами. Чем выше температура перегрева (при данном давлении), тем ближе пар по своим свойствам к идеальному газу.
Дата добавления: 2015-08-14; просмотров: 2654;
