Изотермический процесс.
|
При изотермическом процессе температура постоянна, следовательно,
рV = RТ = сопst, или p2/p1 = υ1/υ2 [49]
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении — падает (закон Бойля — Мариотта, 1662г.).
Графиком изотермического процесса в р,V - координатах, как показывает уравнение (4.12), является разнобокая гипербола, для которой координатные оси служат асимптотами (рис. 16).
Работа процесса
l = 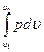 =
=  [50]
[50]
Так как температура не меняется, то внутренняя энергия идеального газа в данном процессе остается постоянной (Δu = 0) и вся подводимая к газу теплота полностью превращается в работу расширения: q = l
При изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе.
Из соотношений 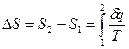 и [49] следует, что изменение энтропии в изотермическом процессе выражается формулой
и [49] следует, что изменение энтропии в изотермическом процессе выражается формулой
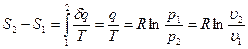 [51]
[51]
Адиабатный процесс. Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным, т. е. δq = 0. Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
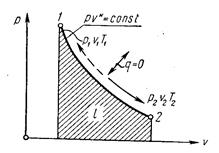 Уравнения первого закона термодинамика для адиабатного процесса принимают вид:
Уравнения первого закона термодинамика для адиабатного процесса принимают вид:
cpdT - υdp = 0; cυdT + pdυ = 0 Поделив первое уравнение на второе, получим
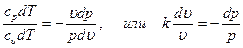
|
Интегрируя последнее уравнение при условии, что k = ср/cυ = const  , находим
, находим
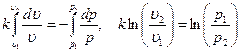 После потенцирования имеем
После потенцирования имеем 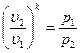 или
или
 [52]
[52]
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const).
Величина k = cp/cυ [53]
называется показателем адиабаты. Подставив cp = cυ + R, получим k = 1 + R/cυ Согласно классической кинетической теории теплоемкость газов не зависит от температуры поэтому можно считать, что величина k также не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k =1,66, для двухатомного k =1,4, для трех-и многоатомных газов k =1,33.
Поскольку k > 1, то в координатах р, υ (рис. 4.4) линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Определив из уравнения состояния, написанного для состояний 1 и 2, отношение объемов или давлений и подставив их в [52], получим уравнение адиабатного процесса, устанавливающего связь между р и υ; υ и Т; р и Т и термическим уравнением состояния для этих же точек p1υ1 =RT1 p2υ2 = RT2 или 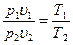 В результате несложных математических преобразований получим
В результате несложных математических преобразований получим
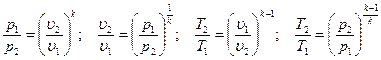 [54]
[54]
Из первого закона термодинамики при q = 0 для адиабатного процесса следует Δu +l =0 тогда l = -Δu = cυ . (T1-T2) = 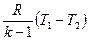 (Теплоемкость адиабатного процесса также равна нулю).
(Теплоемкость адиабатного процесса также равна нулю).
Следовательно, работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии газа. В обратном процессе сжатия работа, совершаемая внешней средой над газом, идет на увеличение внутренней энергии газа, на повышение его температуры.
так как p1υ1 =RT1 p2υ2 = RT2 то 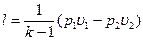 [55]
[55]
Еще раз повторим, что в данном процессе теплообмен газа с окружающей средой исключается, поэтому δq = 0. Выражение с=δq/Tпоказывает, что теплоемкость адиабатного процесса также равна нулю.
Поскольку при адиабатном процессе δq = 0, энтропия рабочего тела неизменяется (ds = 0, s = const). Следовательно, на Т, S-диаграмме адиабатный процесс изображается вертикалью.
Политропный процесс и его обобщающее значение.Любой произвольный процесс можно описать в р, v-координатах (по крайней мере на небольшом участке) уравнением подбирая соответствующее значение п.
pυn = const, [56]
Процесс, описываемый уравнением pυn = const, называется политропным (от греческих слов поли- много и тропос-путь, направление). Показатель политропы п может принимать любое численное значение в пределах от 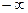 до
до 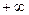 , но для данного процесса он является величиной постоянной.
, но для данного процесса он является величиной постоянной.
pυn = const,
Описанные четыре основных процесса можно рассматривать как частные случаи политропного процесса. Действительно, при n = 0 уравнение политропы приобретает вид рυn = pυ0 = р = сonst, получаем уравнениеизобары.
При n = 1 рυn = pυ = сonst, имеем уравнение изотермы
При n = k рυn = pυk = сonst, - уравнение адиабаты.
Извлекая из обеих частей уравнения рυn = сonst, корень n-й степени и приравнивая 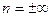 , получаем
, получаем 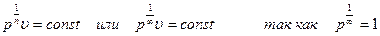 то получаем уравнение υ = сonst, т. е. уравнение изохоры.
то получаем уравнение υ = сonst, т. е. уравнение изохоры.
Из уравнения (4.21) и уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между р, υи Т в любых двух точках наполитропе, аналогично тому, как это было сделано для адиабаты:
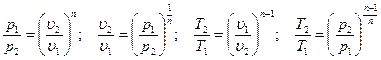 [57]
[57]
Работа расширения газа в политропном процессе имеет вид l= 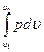
так как для политропы в соответствии с [57] 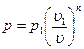 то
то
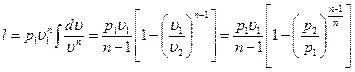 [58]
[58]
Преобразуем эти уравнения к виду
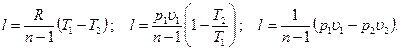 [59]
[59]
Количество подведенной (или отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики: q = (u2 – u1) + l так как
u2 – u1 = сυ(Т 2-Т1), l= 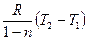 то
то 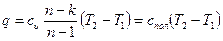 [60]
[60]
где спол = 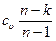 представляет собой теплоемкость идеального газа в политропном процессе. При постоянных cυ, и и п теплоемкость спол= соnst, поэтому политропный процесс иногда определяют как процесс с постоянной теплоемкостью.
представляет собой теплоемкость идеального газа в политропном процессе. При постоянных cυ, и и п теплоемкость спол= соnst, поэтому политропный процесс иногда определяют как процесс с постоянной теплоемкостью.
Изменение энтропии при политропном процессе найдем из формулы:
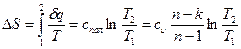 .[61]
.[61]
Дата добавления: 2015-08-14; просмотров: 1634;
