Боровская теория атома.
Лекция 9. ФИЗИКА АТОМОВ
Закономерности в атомных спектрах.
Излучение атомов несет информацию об атомах, то есть может служить инструментом изучения строения атомов. Излучение невзаимодействующих друг с другом атомов (для веществ, находящихся в газообразном состоянии) состоит из отдельных спектральных линий, то есть в излучении присутствуют электромагнитные волны лишь определенных частот. Такой спектр излучения называется линейчатым.
Было установлено, что частотное расположение линий атомных спектров не беспорядочно, их можно объединить в группы, или, иначе, серии линий. Для простейшего объекта исследования – атома водорода – было установлено, что частоты наблюдаемых линий в спектре описываются так называемой сериальной формулойБальмера-Ридберга:
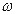 =
= 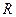 (
( 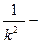
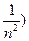 ,
,
где 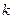 = 1, 2, 3,… - номер серии, а
= 1, 2, 3,… - номер серии, а 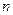 =
= 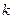 +1,
+1, 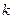 +2, …- целое число, определяющее линии в пределах серии:
+2, …- целое число, определяющее линии в пределах серии:
при 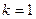
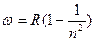 - серия Лаймана (ультрафиолетовая
- серия Лаймана (ультрафиолетовая
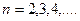 область спектра);
область спектра);
при 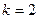
 - серия Бальмера (видимая область
- серия Бальмера (видимая область
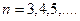 спектра;
спектра;
при 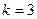
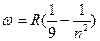 - серия Пашена (инфракрасная область
- серия Пашена (инфракрасная область
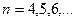 спектра);
спектра);
при 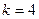 и 5, соответственно, серии Брэкета и Пфунда (рис.1).
и 5, соответственно, серии Брэкета и Пфунда (рис.1).
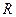 = 2,07 · 1016 рад/с – постоянная Ридберга.
= 2,07 · 1016 рад/с – постоянная Ридберга.
При возрастании 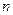 в пределах одной серии частота стремится к предельному значению
в пределах одной серии частота стремится к предельному значению 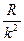 , которое называется границей серии.
, которое называется границей серии.
Вводят физическую величину, определяемую как 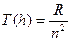 , которая получила название спектрального терма (или просто «терм»). Тогда нетрудно убедиться, что любая частота спектральной линии водорода определяется разностью двух термов
, которая получила название спектрального терма (или просто «терм»). Тогда нетрудно убедиться, что любая частота спектральной линии водорода определяется разностью двух термов 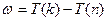 .
.
Очевидно, что в дискретной структуре атомных спектров проявляются квантовые закономерности. Энергия излучаемых квантов составляет
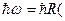
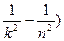 .
.
Наибольшая частота соответствует 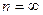 , что соответствует энергии ионизации атома. При ионизации атома водорода затрачивается энергия
, что соответствует энергии ионизации атома. При ионизации атома водорода затрачивается энергия 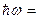 13.6 эВ. Поэтому энергию квантов серии можно найти следующим образом
13.6 эВ. Поэтому энергию квантов серии можно найти следующим образом 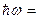
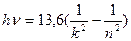 эВ.
эВ.
Классические модели атома
Какими сведениями располагали ученые, впервые попытавшиеся объяснить строение атома в рамках классической теории? К числу таких сведений следует отнести следующие:
1) спектры излучения атомов состоят из ряда монохроматических линий, частоты которых подчинены сериальной формуле Бальмера-Ридберга;
2) при внешних воздействиях (например, при фотоэффекте) может происходить ионизация атомов, т.е. разделение атомов на электроны и положительные ионы;
3) атом электронейтрален и примерно в 2000 раз тяжелее электрона;
4) размеры атома, оцененные на основе молекулярно-кинетической теории, определяются величиной порядка
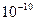 м (1A).
м (1A).
Одна из первых моделей атома была предложена Дж.Дж.Томсоном в 1903г. Томсон определил атом как «каплю» положительной электрической жидкости, в которой помещены электроны, расположенные таким образом, что вся система в целом оставалась нейтральной. Эта модель объясняла нейтральность атомов и возможность испускания ими электронов. Чтобы объяснить излучение света атомом, Томсон предположил, что электрон в капле может колебаться.
Применительно к атому водорода в состоянии равновесия электрон находится в центре положительно заряженной сферы (рис.2). При смещении из центра на него действует возвращающая сила, модуль которой равен 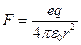 , где
, где 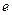 - заряд электрона,
- заряд электрона, 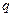 - положительный заряд сферы радиуса
- положительный заряд сферы радиуса 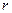 , равного радиусу смещения. Заряд
, равного радиусу смещения. Заряд 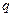 можно определить из выражения
можно определить из выражения 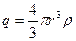 , где
, где 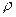 - плотность заряда, равная
- плотность заряда, равная 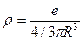 (
( 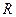 - радиус «капли»). С учетом выражений для
- радиус «капли»). С учетом выражений для 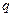 и
и 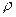 , возвращающая квазиупругая сила определяется как
, возвращающая квазиупругая сила определяется как 
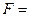
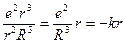 , где коэффициент упругости
, где коэффициент упругости 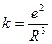 . Тогда собственную частоту колебаний электрона в атоме можно определить по формуле
. Тогда собственную частоту колебаний электрона в атоме можно определить по формуле 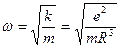 . Если положить
. Если положить 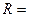 1А, то
1А, то 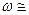 1015 рад/с.
1015 рад/с.
Однако модель Томсона не позволяет объяснить сериальный характер излучения.
В 1904 г. Х.Нагаока предложил модель атома, согласно которой атом состоит из положительно заряженного ядра, вокруг которого вращается кольцо, содержащее значительное число электронов («атом типа Сатурна»). Модель Нагаоки не привлекла к себе внимание физиков, хотя в определенной мере ее можно считать предшественницей ядерной модели Резерфорда.
Э.Резерфорд (1911 г.) зондировал внутренние области атомов при помощи 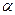 - частиц (двукратно положительно заряженных ионов гелия He2+). В опытах параллельный пучок
- частиц (двукратно положительно заряженных ионов гелия He2+). В опытах параллельный пучок 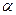 -частиц направлялся в вакууме на тонкую металлическую фольгу и рассеивался ею. Оказалось, что подавляющее число
-частиц направлялся в вакууме на тонкую металлическую фольгу и рассеивался ею. Оказалось, что подавляющее число 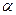 -частиц рассеивалось на небольшие углы порядка
-частиц рассеивалось на небольшие углы порядка 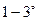 . Но небольшое число
. Но небольшое число 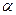 -частиц (в среднем одна из 8000) отклонялось на углы, близкие к
-частиц (в среднем одна из 8000) отклонялось на углы, близкие к 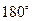 . Это свидетельствовало об отражении
. Это свидетельствовало об отражении 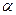 -частицы от положительного объекта с массой много больше массы
-частицы от положительного объекта с массой много больше массы 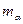 . Такое возможно лишь при центральном ударе и, если импульс
. Такое возможно лишь при центральном ударе и, если импульс 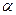 -частицы меняется на противоположный, то существует минимальное расстояние
-частицы меняется на противоположный, то существует минимальное расстояние 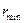 , на котором кинетическая энергия частицы полностью переходит в потенциальную энергию отталкивания. Из закона сохранения энергии
, на котором кинетическая энергия частицы полностью переходит в потенциальную энергию отталкивания. Из закона сохранения энергии
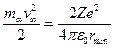 .
.
Для 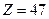 (серебро)
(серебро) 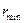
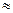
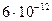 см. Это на четыре порядка меньше размеров атома. Основываясь на этом выводе, Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома (рис.3).Согласно Резерфорду, атом представляет собой систему зарядов, в центре которой расположено тяжелое ядро с зарядом +Z
см. Это на четыре порядка меньше размеров атома. Основываясь на этом выводе, Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома (рис.3).Согласно Резерфорду, атом представляет собой систему зарядов, в центре которой расположено тяжелое ядро с зарядом +Z 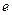 , имеющее размеры ~ 10-12 см, а вокруг ядра вращаются Z электронов на расстоянии ~ 10-8 см. Однако ядерная модель Резерфорда не согласовалась с законами классической механики и электродинамики. Эти противоречия состоят в следующем.
, имеющее размеры ~ 10-12 см, а вокруг ядра вращаются Z электронов на расстоянии ~ 10-8 см. Однако ядерная модель Резерфорда не согласовалась с законами классической механики и электродинамики. Эти противоречия состоят в следующем.
Резерфорд предположил, что для того, чтобы электроны не упали на ядро, они должны вращаться вокруг ядра, тогда сила кулоновского притяжения выполняет роль центростремительной силы. Но в таком случае электроны движутся с ускорением и согласно законам классической электродинамики они должны непрерывно излучать электромагнитные волны. Поскольку процесс излучения приводит к уменьшению энергии электрона, он должен в конечном счете упасть на ядро.
Другое противоречие модели Резерфорда заключается в том, что частота излучаемого света должна непрерывно меняться, т.к. 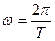 , а
, а 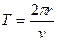 , но
, но 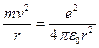 , откуда
, откуда 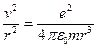 , т.е.
, т.е. 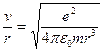 . Таким образом,
. Таким образом, 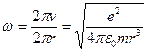 , но радиус непрерывно уменьшается, значит, частота должна непрерывно возрастать, т.е. спектр излучения атома должен быть непрерывным (сплошным), а опыт показывает, что он линейчатый.
, но радиус непрерывно уменьшается, значит, частота должна непрерывно возрастать, т.е. спектр излучения атома должен быть непрерывным (сплошным), а опыт показывает, что он линейчатый.
Дата добавления: 2015-08-14; просмотров: 841;
