Основные закономерности химической кинетики
Изменение содержание вещества в технологических аппаратах происходит как за счет переноса вещества движущимся потоком, так и за счет химических превращений исходных веществ в продукты реакции. Скорости химических превращений описываются на основании закономерностей химической кинетики.
Основным понятием химической кинетики является скорость химической реакции. Она определяется как число молекул (или кило молей) реагирующих в единицу времени в единице объема:
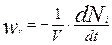 (4.1.1)
(4.1.1)
где V –объем реагирующей системы, м3; Ni – число молей (или килограмм-молей) реагирующего вещества.
Если объем реакционной смеси постоянный, т.е. V=const, то уравнение (4.1) можно записать следующим образом:
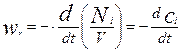 (4.1.2)
(4.1.2)
где 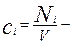 концентрация реагирующего вещества
концентрация реагирующего вещества
В основе вывода уравнений кинетических моделей лежит основной постулат химической кинетики - закон действия масс. Если в реагирующей системе протекает реакция в соответствии со следующим стехиометрическим уравнением
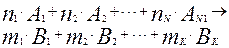 (4.1.3)
(4.1.3)
где 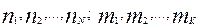 – стехиометрические коэффициенты реагирующих веществ,
– стехиометрические коэффициенты реагирующих веществ, 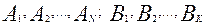 – компоненты реакции, то в соответствии с законом действия масс скорость реакции пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам, т.е.:
– компоненты реакции, то в соответствии с законом действия масс скорость реакции пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам, т.е.:
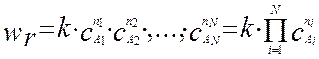 (4.1.4)
(4.1.4)
где 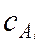 – концентрация i-го компонента, кмоль/м3;
– концентрация i-го компонента, кмоль/м3;
N – число компонентов;
k – константа скорости реакции, определяемая как скорость реакции при условии, что концентрации всех компонентов постоянны и равны единице.
Константа скорости химической реакции зависит от температуры в соответствии с уравнением Аррениуса:
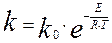 (4.1.5)
(4.1.5)
где Е – энергия активации, кДж/моль; Т- абсолютная температура, К;
R - универсальная газовая постоянная, кДж/(моль×К).
Основной постулат химической кинетики вытекает из того физически очевидного положения, что реагировать могут только те молекулы, которые сталкиваются между собой, а число столкновений пропорционально числу частиц, содержащихся в единице объема. Константа скорости в этом случае равна числу столкновений, приводящих к реакции. Температурная зависимость константы скорости отражает тот факт, что не каждое столкновение приводит к реакции, а только та часть, которая в момент столкновения обладает энергией, не меньшей некоторой энергии, необходимой для прохождения реакции в момент столкновения. Эта часть активных столкновений и выражается множителем 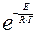 , вытекающим из распределения молекул по энергиям.
, вытекающим из распределения молекул по энергиям.
В курсе химической кинетики проводится подробная классификация химических реакций с кинетической точки зрения. Мы рассмотрим некоторые особенности этой классификации, необходимые для вывода и использования кинетических моделей для моделирования технологических объектов. Прежде всего, можно разделить реакции на гомогенные и гетерогенные.
Гомогенные реакции протекают в пределах одной фазы, и их скорость относится к единице объема реакционной фазы.
Гетерогенные реакции протекают на поверхности раздела фаз, их скорость следует относить к единице поверхности, поэтому их скорость пропорциональна концентрациям реагентов на поверхности раздела фаз. Однако если ввести понятие удельной поверхности раздела фаз, т.е. поверхности, приходящейся на единицу реакционного объема, то скорость реакции уже может быть отнесена к единице объема реакционного пространства, и гетерогенные реакции можно записать с помощью тех же уравнений, что и гомогенные. В этом случае для описания гетерогенных процессов используется так называемая квазигомогенная модель.
Поэтому мы, в основном, рассмотрим закономерности описания гомогенных реакций, имея в виду, что гетерогенные реакции можно описать с помощью аналогичных соотношений, с использованием эффективной константы скорости, учитывающей описание скорости на поверхности и удельную поверхность контакта фаз.
Реакции можно разделить также на простые и сложные.
Пример простой реакции:
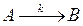
Пример сложных реакций:
а) последовательные реакции 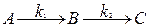
б) параллельные реакции
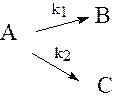
в) обратимые реакции
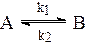
При описании кинетики сложных реакций наряду с законом действия масс используется принцип независимости реакций. Согласно этому принципу скорость любой реакции не зависит от того, протекают ли в системе еще другие реакции. С использованием этих двух принципов - закона действия масс и принципа независимости реакций - легко записать дифференциальные уравнения для скоростей реакций в реагирующей системе любой сложности:
Рассмотрим, например, вывод кинетических уравнений для реагирующей системы, в которой протекают следующие реакции:
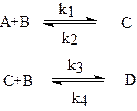
Запишем кинетические уравнения для 1-й и 2-й реакций, выразив их скорости через изменение концентраций продуктов реакций:
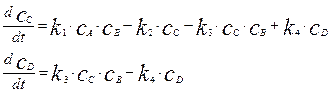 (4.1.6)
(4.1.6)
где 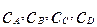 – текущие концентрации реагирующих веществ.
– текущие концентрации реагирующих веществ.
Дата добавления: 2015-08-14; просмотров: 965;
