Положение о всеобщем рассеянии химических элементов именуется законом Кларка-Вернадского (Вернадский, 1934; Перельман, 1979).
Современные методы анализа и приборы позволили уточнить содержание элементов в земной коре. Половина земной коры состоит из кислорода. Таким образом, земная кора – это «кислородная сфера». На втором месте кремний, далее алюминий. Если к ним добавить железо, кальций, калий, натрий, магний, титан, то получится 99,48%, т.е.практически вся земная кора. На остальные 80 элементов приходится менее 1%. Элементы, содержание которых не превышает 0,01-0,0001%, называют редкими. Если редкие элементы не образуют собственных минералов, их называют «редкими рассеянными» (Br, In, Ra, U, Se и др.)
Рассеянные элементы, группа химических элементов (Rb, Cd, Cs, Sc, Ga, In, Tl, Ge, Hf, V, Se, Te, Re), встречающихся в природе главным образом в виде примеси в различных минералах и извлекаемых попутно из руд др. металлов или полезных ископаемых...
В 1923 году В.М. Гольдшмидт сформулировал основной закон геохимии: общая распространенность элемента зависит от свойств его атомного ядра, а характер распространения – от свойств наружной электронной оболочки его атома.
А.Е. Ферсман получил график зависимости атомных кларков от заряда ядра для четных и нечетных элементов периодической системы Д. И. Менделеева. Он выяснил, что с усложнением атомного ядра, увеличением его
массы кларки элементов уменьшаются, но эти кривые оказались немонотонными. Легкие атомы (занимающие места в начале периодической системы) более распространены. Их ядра содержат небольшое число нуклонов (протонов и нейтронов). Действительно, после железа (Z= 26) нет ни одного распространенного элемента. На это указывал еще Д. И. Менделеев. В 1869 г. одновременно с периодическим законом он сформулировал правило: элементы с малыми атомными весами в общем более распространены, чем тяжелые элементы.
Распространенность элементов с четными порядковыми номерами больше соседних с нечетными номерами. Лёгкие элементы Li, Be, B находятся в дефиците, т. к. «сгорают» в реакциях с протонами. Ядра элементов конца Менделеевской системы имеют огромный избыток нейтронов и потому неустойчивы. Эти элементы претерпевают радиоактивный распад (U, Th, Ra и др.) и спонтанное деление (U, Th, некоторые актиниды).
Другая закономерность была установлена в 1914 г. Г.Оддо (Италия) и В. Гаркинсоном (США) в 1915-1928 гг. Они заметили, что в земной коре преобладают элементы с четными порядковыми номерами и четными атомными
массами. Среди соседних элементов у четных кларки всегда выше, чем у нечетных (рис.1.5).
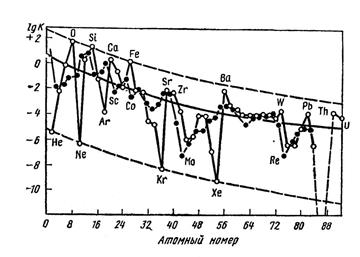
Рис. 1.5. Логарифмы кларков элементов по А.Е Ферсману (Войткевич, 1977)
Таким образом, распространенность элементов в земной коре связана преимущественно со строением атомного ядра. В земной коре преобладают ядра с небольшим и четным числом протонов и нейтронов. Причина этого лежит в звездной стадии существования земной материи. Свыше 4,5 млрд лет назад вещество нашей планеты было нагрето до десятков миллионов градусов. При таких температурах ни атомы, ни молекулы существовать не могут, и вещество представляло собой раскаленную плазму со свободными электронами и ядрами. В плазме протекали ядерные реакции – из протонов и нейтронов образовывались ядра химических элементов. Вероятнее всего образование наиболее устойчивых ядер, а такими являются ядра, содержащие небольшое и четное количество протонов и нейтронов. Ядра же, переполненные протонами и нейтронами, неустойчивы и распадаются. Таковы уран, торий, радий и другие радиоактивные элементы, распадающиеся с образованием свинца и гелия.
Дата добавления: 2015-08-14; просмотров: 2943;
