Строение атома водорода по Бору
К началу 20 века реальность атомов стала общепризнанной. Было установлено существование положительных и отрицательных зарядов и открыт носитель отрицательного заряда — электрон. Было ясно, что атомы составляют сложную электродинамическую систему размером порядка 10-30 м. Стал актуальным вопрос о строении атома. Поскольку атом в целом электронейтрален, то положительные и отрицательные заряды, составляющие его, должны взаимно компенсироваться.
В 1906 году Эрнест Резерфорд, профессор Мак-Гиллского университета в Квебеке, изучая явление прохождения а-частиц (дважды ионизированных атомов гелия) через вещество, обнаружил их рассеяние. В 1911 году, уже будучи профессором Манчестерского университета, Э.Резерфорд завершил свои иссследо- | вания, установив закон рассеяния а-частиц атомами различных { элементов и предложил планетарную модель атома.
Схема опытов Резерфорда показана на рис. 1. Испускаемые радиоактивным веществом а-частицы двигались в вакууме и проходили затем через металлическую фольгу F толщиной ~ 1 мкм. После рассеяния на фольге они попадали на на минее пирующий экран Q.Удар каждой а-частицы об экран вызывал кратковременную вспышку - сцинтилляцию , наблюдаемую в микроскоп.

| Здесь λ — длина волны, R= 1,0974 • 107 м-1 — постоянная Рид-берга, п >3 — целое число, которое для видимой части спектра |
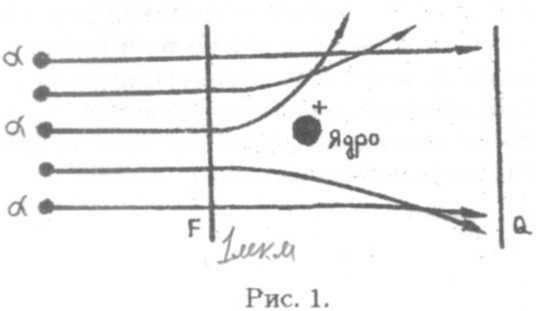
Испускаемые радиоактивными элементами а-частицы движутся со скоростью порядка 104 км/с, имеют положительный заряд, равный двум элементарным зарядам, и массу в 7350 раз большую массы электрона. Наблюдения показали, что большинство а-частиц проходят всю фольгу без заметного отклонения от первоначального направления. Некоторые частицы отклоняются на небольшой угол и лишь немногие частицы претерпевают сильное отклонение.
Полагая, что положительный заряд, входящий в состав атома, и а-частица взаимодействуют по закону Кулона, Резерфорд ввел понятие ядра атома, теоретически рассчитал картину рассеяния а-частиц, получив результат, хорошо согласующийся с опытными данными.
Исследования Резерфорда показали, что ядро имеет размер порядка 10-15 м . При этом оказалось, что его заряд q,выраженный в элементарных зарядах е, равен порядковому номеру Zхимического элемента в таблице Менделеева. Он так же равен числу электронов в электронной оболочке атома.
Резерфорд предположил, что электроны движутся вокруг ядра по замкнутым эллиптическим орбитам, подобно тому, как планеты движутся вокруг Солнца.
Однако резерфордовская модельатома не соотегствовала законам классической электродинамики. Согласно им электрон, вращаясь вокруг ядра, т.е. двигаясь с центростремительным ускорением, должен непрерывно излучать электромагнитные волны. В результате этого он будет терять энергию и приближаться к ядру. Как показывают оценки, за время ~ 10-8 с электрон должен упасть на ядро. В действительности этого не происходит атом стабилей. Кроме того, для внешнего наблюдателя спектр излучения атомов в модели Резерфорда должен быть непрерывным. Как показали опыты по наблюдению спектров излучения атомов, это не так.
В 1885 году швейцарский физик и математик Иоганн Якоб Бальмер, проводя физические исследования в области спектроскопии, обнаружил, что спектр излучения атома водорода в видимой части спектра является линейчатым. Он показал, что длины волн линий видимой части спектра атома водорода можно определить с помощью простой формулы
может принимать значения n = 3, 4, 5, 6, 7. Формула (1) оказалась верной и при п = 8, 9, 10...; но в этом случае спектральные линии уже лежат в ультрафиолетовой части спектра. Таким образом, в видимой части спектра излучения атома водорода наблюдается только пять спектральных линий.
В 1890 году шведский физик и математик Иоганнес Роберт Ридберг обобщил формулу Бальмера, получив формулу, определяющую любую спектральную линию в спектре атома водорода:

Здесь m = 1, 2, 3...; п — целое число, большее, чем m, п = m + 1, m + 2, m 4- 3—
Таким образом, в спектре излучения и поглощения атома водорода оказывается бесконечно большое количество серий. Наиболее известными из них и часто используемыми на практике
являются серии Лаймана (m = 1), Бальмера (m = 2), Пашена (т = 3), Брекета (m = 4), Пфунда (m = 5).
Противоречия, возникшие в теории атома Резерфорда, стимулировали исследования в этой области. В 1913 году датский физик-теоретик Нильс Хендерик Давид Бор, работавший в это время в Манчестере у Э. Резерфорда, усовершенствовал модель атома Резерфорда, сформулировав ряд дополнительных утверждений, которые в дальнейшем получили название постулатов Бора.
Дата добавления: 2015-08-11; просмотров: 1141;
