Теплоемкость твердых тел
Каждая частица в твердом теле может колебаться вблизи своего положения равновесия во всех направлениях, т.е. имеет три степени свободы. Согласно теореме Больцмана на каждую степень свободы приходится средняя кинетическая энергия кТ/2. Поэтому средняя кинетическая энергия Wk = 3кТ/2. Кроме кинетической каждая частица твердого тела обладает значительной потенциальной энергией (в отличие от случая идеального газа). При достаточно высоких температурах различные частицы можно считать независимыми гармоническими осцилляторами. У гармонического осциллятора средняя потенциальная и средняя кинетическая энергии совпадают и поэтому полная средняя энергия одной частицы равна:
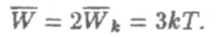
Полная внутренняя энергия одного моля вещества U получается умножением W на число независимых колеблющихся частиц. В одном моле химически простыхвеществ содержится Na (число Авогадро) независимо колеблющихся частиц (атомов; под словом "моль" для таких веществ следует понимать грамм-атом), то есть

где R = 8.31 Дж/(К*моль) — универсальная газовая постоянная. Так как твердые тела имеют очень маленький коэффициент теплового расширения, то для них теплоемкости при постоянном объеме и при постоянном давлении практически совпадают и можно говорить просто о молярной (а для химически простых веществ — об атомной теплоемкости С), численно равной увеличению внутренней анергии U при повышении температуры на 1 К. Согласно (3), С = 3R 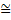 25 Дж/(К ∙ моль). Получаем закон Дюлонга и Пти:
25 Дж/(К ∙ моль). Получаем закон Дюлонга и Пти:
Атомная теплоемкость всех химически простых твердых тел при достаточно высокой температуре равна 25 Дж/(град ∙ моль).
Если имеем дело не с химически простым веществом, а с соединением, молекула которого состоит из т» атомов, то в моле этого вещества содержится nNAчастил и молярная теплоемкость такого соединения С — 25•n Дж/(К ∙ моль).
Молярная теплоемкость твердых химических соединений при достаточно высокой температуре равна сумме атомных теплоемкостей входящих в него элементов (Джоуль и Копп, 1888).
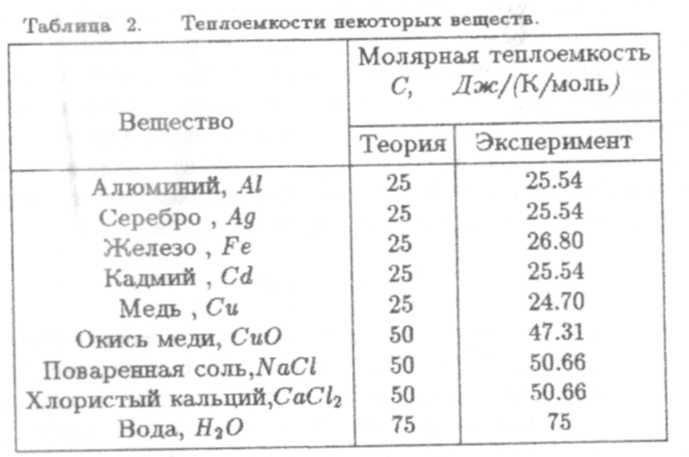
В табл. 2 приведены теоретические и экспериментальные значения теплоемкостей как химически простых веществ, так и соединений. Согласие между теорией и экспериментом достаточно удовлетворительное. Заметим, что закон Джоуля-Коппа имеет большую степень общности, чем закон Дюлонга-Пти и выполняется даже тогда, когда последний не работает.
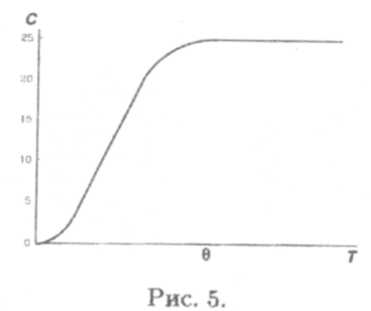
С уменьшением температуры теплоемкости всех веществ снижаются, обращаясь в ноль при 0˚К (рис. 5), что можно объяснить только с позиций квантовой механики. Законы Дюлонга-Пти и Джоуля-Коппа верны при температурах, превышающих температуру Дебая , свою для каждого вещества. Законы эти выполняются и для жидкостей, хотя хуже, чем для твердых тел.
Лекция № 18
Дата добавления: 2015-08-11; просмотров: 1386;
