Исходные вещества Активный комплекс Продукты реакции
Для образования активного комплекса нужно преодолеть некоторый энергетический барьер, затратив энергию ЕА. Эта энергия и есть энергия активации – некоторая избыточная энергия, по сравнению со средней при данной температуре энергией, которой должны обладать молекулы для того, чтобы их столкновения были эффективными.
В общем случае для химической реакции А + В = С +Д переход от исходных веществ А и В к продуктам реакции С и Д через состояние активного комплекса А + В = А¼В = С + D схематически можно представить в виде энергетических диаграмм (рис. 6.2).
   |
Энергия активации ЕА – один из основных параметров, который характеризует скорость химического взаимодействия. Она зависит от природы реагирующих веществ. Чем больше ЕА, тем меньше (при прочих равных условиях) скорость реакции. При повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость реакции.
Обычно реакции между веществами с прочными ковалентными связями характеризуются большими значениями ЕА и идут медленно, например:
| а) взаимодействия между органическими веществами | Скорость этих процессов при стандартных условиях близка к нулю |
| б) H2 + 1/2О2 = H2О | |
| в) N2 + 3H2 = 2NH3 |
Низкими значениями ЕА и очень большими скоростями характеризуются ионные взаимодействия в растворах электролитов. Например:
Ca+2 + SO 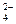 = CaSO4.
= CaSO4.
Объясняется это тем, что разноименно заряженные ионы притягиваются друг к другу и не требуется затрат энергии на преодоление сил отталкивания взаимодействующих частиц.
Дата добавления: 2015-08-11; просмотров: 1022;
