Энтальпия
Энтальпия (тепловая функция)–сумма внутренней энергии системы U и произведения давления системы р на ее объем V, Дж,
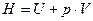 , (1.11)
, (1.11)
Энтальпия является функцией состояния, так как входящие в нее величины являются функциями состояния.
Величина
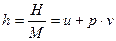 ,
,
называется удельной энтальпией, 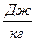 .
.
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
h=ψ1(p,v); h=ψ2(v,T); h=ψ3(p,T).
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса. Соответственно величина dh является полным дифференциалом.
Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, рис.1.5, включающую газ в цилиндре и поршень с грузом общим весом G.
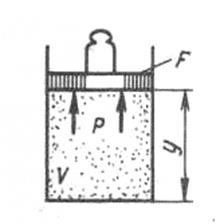
Рис. 1.5. К определению физического смысла
энтальпии
Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: Е=U+Gy. В условиях равновесия ( 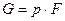 ) эту функцию можно выразить через параметры газа:
) эту функцию можно выразить через параметры газа: 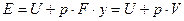 . Получаем, что
. Получаем, что 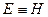 , т.е. энтальпию можно трактовать как энергию расширенной системы.
, т.е. энтальпию можно трактовать как энергию расширенной системы.
В практических расчетах в основном используют изменение энтальпии в конечном процессе (например при расчете количества теплоты подведенной в паровых котлах, в камерах сгорания ГТ и двигателей, теплообменных аппаратах).
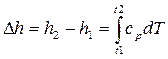 .
.
Дата добавления: 2015-08-11; просмотров: 691;
