Теплоемкость газов
Отношение количества теплоты δQ полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела dT называется теплоемкостью тела в данном процессе, 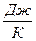
 , (1.10)
, (1.10)
Например: при расчете тепловой аппаратуры наиболее важным моментом является определение количества теплоты, участвующее в процессе. Точное его определение обеспечивает правильную оценку работы аппарата с экономической точки зрения, что является особенно ценным при сравнительных испытаниях.
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают:
1) удельную массовую теплоемкость с, отнесенную к 1 кг газа, 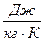 ;
;
2) удельную объемную теплоемкость сI, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях, 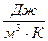 ;
;
3) удельную мольную теплоемкость μс, отнесенную к одному киломолю, 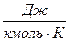 .
.
Между указанными теплоемкостями существует следующая связь:
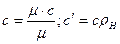 ,
,
где 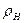 – плотность газа при нормальных условиях.
– плотность газа при нормальных условиях.
Теплоемкость является функцией процесса, так как изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса. Численно величина с изменяется в пределах от 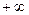 до
до 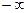 .
.
В термодинамических расчетах используют:
1) теплоемкость при постоянном давлении
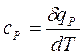 ,
,
равная отношению количества теплоты 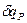 , сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT.
, сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT.
2) теплоемкость при постоянном объеме
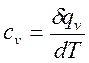 ,
,
равная отношению количества теплоты 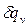 , сообщенной телу в процессе при постоянном объеме, к изменению температуры тела dT.
, сообщенной телу в процессе при постоянном объеме, к изменению температуры тела dT.
Связь между теплоемкостями 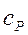 и
и 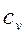 для идеальных газов показывает уравнение Майера:
для идеальных газов показывает уравнение Майера:
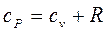 .
.
В процессе при v=const теплота, сообщаемая газу, идет лишь изменение его внутренней энергии, тогда как в процессе при р=const теплота расходуется и на увеличение внутренней энергии и совершение работы против внешних сил. Поэтому 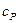 больше
больше 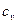 на величину этой работы. Удельная газовая постоянная R, таким образом, представляет собой работу расширения 1 кг газа при его нагревании на 1 К при постоянном давлении.
на величину этой работы. Удельная газовая постоянная R, таким образом, представляет собой работу расширения 1 кг газа при его нагревании на 1 К при постоянном давлении.
Для реальных газов 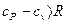 , поскольку при их расширении (при p=const) совершается работа не только против внешних сил, но и против сил притяжения, что вызывает дополнительный расход теплоты.
, поскольку при их расширении (при p=const) совершается работа не только против внешних сил, но и против сил притяжения, что вызывает дополнительный расход теплоты.
Обычно теплоемкости определяются экспериментально или методами статической физики.
Теплоемкость реального газа в основном зависит от температуры и очень слабо от давления. Исходя из этого, различают истинную и среднюю теплоемкости.
Средняя теплоемкость сср данного процесса в интервале температур от t1 до t2 – это отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:
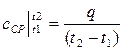 .
.
Истинная теплоемкость с – это теплоемкость при данной температуре Т. Ее определяет выражение
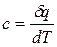 .
.
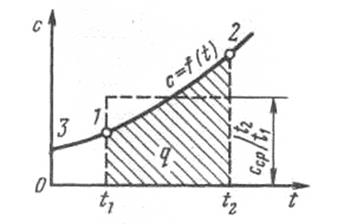
Рис. 1.4. Зависимость истинной теплоемкости от
температуры
Дата добавления: 2015-08-11; просмотров: 740;
